题目内容
7.黑火药是中国古代四大发明之一,已知它在爆炸时发生反应的化学方程式为:S+2KNO3+3C═A+N2↑+3CO2↑ (已配平,A特指某一晶体);请回答下列问题:
①除S外,上述元素的电负性从大到小依次为O>N>C>K(填写元素符号).
②在生成物中,A的晶体类型为离子晶体,含极性共价键的分子内的中心原子轨道杂化类型为sp.
③已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为1:1.
分析 ①同周期自左而右电负性增大,金属性越强电负性越小,据此解答;
②由原子守恒可知,物质A为K2S,属于离子晶体;含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键.
解答 解:①同周期自左而右电负性增大,金属性越强电负性越小,故电负性O>N>C>K,
故答案为:O>N>C>K;
②由原子守恒可知,物质A为K2S,属于离子晶体,含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2,为sp杂化方式,
故答案为:离子晶体;sp;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1,
故答案为:1:1.
点评 本题考查了电负性、晶体类型、杂化轨道、等电子体等知识,题目难度不大,注意对基础知识的理解掌握,注意③CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为易错点.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
17.与CH3CH2CH=CH2互为同分异构体的是( )
| A. |  | B. | CH2=CH-CH=CH2 | C. | 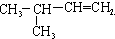 | D. | 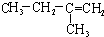 |
18.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.下列关于不溶物之间转化的说法中错误的是( )
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{8.5}{\sqrt{1.8}}$×10-12mol•L-1 |
2.在一个不传热的固定容积的密闭容器中,可逆反应N2+3H2?2NH3达到平衡的标志是( )
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3molH-H键断裂,同时2molN-H键断裂 | |
| C. | n(N2):n(H2):(NH3)=1:3:2 | |
| D. | 反应混合物的压强不再改变 |
12.某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-?H++A2-,关于下列说法不正确的是( )
| A. | NaHA的水溶液可能呈酸性,也可能呈碱性 | |
| B. | 0.1mol•L-1Na2A溶液中,c(A2-)+c(HA-)=0.1 mol•L-1 | |
| C. | NaHA的水溶液中离子浓度关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | Na2A的水溶液中:c(Na+)=2c(HA-)+2c(A2-) |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.7g羟基含有的电子数目为NA | |
| B. | 常温常压下,23g由NO2与N2O4组成的混合气体含有的氮原子数目为0.5NA | |
| C. | 标准状况下,6.72L H2O中含有的水分子数目为0.3NA | |
| D. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA |
16.下列说法能用质量守恒定律解释的是( )
| A. | mg水受热变为mg的水蒸气 | |
| B. | 62g磷和80g氧气反应生成142g五氧化二磷 | |
| C. | 20g食盐溶于80g水得到100g的食盐水 | |
| D. | 拧开盛酒精的瓶盖一段时间后质量变小 |
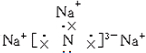 ;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.
;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.