题目内容
【题目】H2SiF6(氟硅酸)是一种基本化工原料,广泛用于制取氟硅酸盐及氟化物等。以氟硅酸和碳酸锂等为原料生产电池级LiF的工艺流程如图:
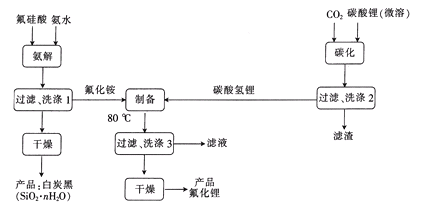
回答下列问题:
(1)生产中采用内衬为聚四氟乙烯或石墨的反应器。聚四氟乙烯的结构简式为____;不用陶瓷设备的原因是____。
(2)“氨解”时发生反应的化学方程式为____,氟化铵的电子式为____。
(3)“碳化”时发生反应的离子方程式为____。
(4)“制备”时产生的气体经分别吸收后返回____和___工序循环使用。
(5)H2SiF6水溶液中存在平衡:SiF62-(aq)+4H2O(1)═Si(OH)4(aq)+4H+(aq)+6F-(aq),该反应的平衡常数表达式为___。
(6)某工厂用纯度为85%的氟硅酸14.4吨和纯度为90%的碳酸锂7.4吨来制备氟化锂,已知流程中氟元素的损耗率为10%,锂元素的损耗率为8%,则最终产品氟化锂为____吨(精确到0.1)。
【答案】![]() —CF2一CF2
—CF2一CF2![]() F-水解生成的HF能与硅酸盐陶瓷中的SiO2反应 H2SiF6+6NH3·H2O=6NH4F+SiO2·nH2O↓+(4-n)H2O(或H2SiF6+6NH3·H2O=6NH4F+SiO2↓+4H2O)
F-水解生成的HF能与硅酸盐陶瓷中的SiO2反应 H2SiF6+6NH3·H2O=6NH4F+SiO2·nH2O↓+(4-n)H2O(或H2SiF6+6NH3·H2O=6NH4F+SiO2↓+4H2O) 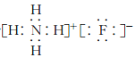 Li2CO3+CO2+H2O=2Li++
Li2CO3+CO2+H2O=2Li++![]() 氨解 碳化
氨解 碳化 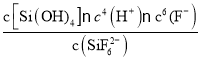 4.3
4.3
【解析】
(1)聚四氟乙烯的单体CF2=CF2,加聚得![]() —CF2一CF2
—CF2一CF2![]() ;F-、HF均能与SiO2反应。
;F-、HF均能与SiO2反应。
(2)“氨解”时,反应物为H2SiF6、NH3·H2O,生成物为NH4F、SiO2·nH2O和H2O,然后写出并配平化学方程式。氟化铵是![]() 和F-构成的离子化合物,电子式为
和F-构成的离子化合物,电子式为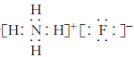 。
。
(3)碳化时发生的反应为Li2CO3+CO2+H2O=2LiHCO3,LiHCO3写成离子形式。
(4)“制备”反应:NH4F+LiHCO3![]() LIF+CO2↑+NH3↑+H2O,NH3被吸收制取氨水返回“氨解”工序,CO2回收返回“碳化”工序。
LIF+CO2↑+NH3↑+H2O,NH3被吸收制取氨水返回“氨解”工序,CO2回收返回“碳化”工序。
(6)1mol H2SiF6中含6mol F-,1mol Li2CO3中只含2mol Li+,由上述数据可以得出H2SiF6过量,按碳酸锂计算。
(1)聚四氟乙烯的单体CF2=CF2,加聚得![]() —CF2一CF2
—CF2一CF2![]() ;陶瓷设备中含有SiO2,F-、HF均能与SiO2反应。
;陶瓷设备中含有SiO2,F-、HF均能与SiO2反应。
(2)“氨解”时,反应物为H2SiF6、NH3·H2O,生成物为NH4F、SiO2·nH2O和H2O,然后写出并配平化学方程式: H2SiF6+6NH3·H2O=6NH4F+SiO2·nH2O↓+(4n)H2O(或H2SiF6+6NH3·H2O=6NH4F+SiO2↓+4H2O)。氟化铵是![]() 和F-构成的离子化合物,电子式为
和F-构成的离子化合物,电子式为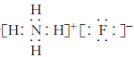 。
。
(3)“碳化”时发生反应:Li2CO3+CO2+H2O=2LiHCO3,LiHCO3写成离子形式。“碳化”时发生反应的离子方程式为:Li2CO3+CO2+H2O=2Li++![]() ;
;
(4)“制备”反应:NH4F+LiHCO3![]() LIF+CO2↑+NH3↑+H2O,NH3被吸收制取氨水返回“氨解”工序,CO2回收返回“碳化”工序。
LIF+CO2↑+NH3↑+H2O,NH3被吸收制取氨水返回“氨解”工序,CO2回收返回“碳化”工序。
(5)SiF62-(aq)+4H2O(1)═Si(OH)4(aq)+4H+(aq)+6F-(aq),该反应的平衡常数表达式为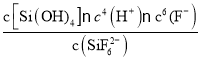 ;
;
(6)1mol H2SiF6中含6mol F-,1mol Li2CO3中只含2mol Li+,由上述数据可以得出H2SiF6过量,按碳酸锂计算,m(LiF)=2×7.4t×90%×92%×26g·mol-1÷74g·mol-1=4.3t。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案