题目内容
13.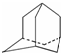 烃A分子的立体结构如图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名“金刚烷”,金刚烷分子中有( )
烃A分子的立体结构如图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名“金刚烷”,金刚烷分子中有( )| A. | 2个-CH3结构 | B. | 4个-CH2-结构 | C. | 4个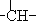 结构 结构 | D. | 6个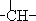 结构 结构 |
分析 由结构可知,含4个CH,6个CH2,不含-CH3结构.
解答 解:A.不含-CH3结构,故A错误;
B.含6个-CH2-结构,故B错误;
C.含4个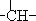 结构,故C正确;
结构,故C正确;
D.含4个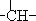 结构,故D错误.
结构,故D错误.
故选C.
点评 本题考查有机物的结构与性质,侧重有机物空间结构的考查,注意碳形成4个化学键及空间对称性是解答的关键,题目难度中等.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
4.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
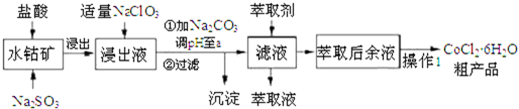
已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成CoCl2.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出加适量NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3 、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发(浓缩)、冷却(结晶)和过滤.
(5)萃取剂对金属离子的萃取率与pH的关系如图1.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B(填选项序号).
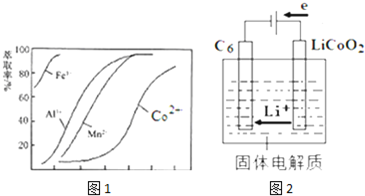
A.2.0~2.5
B.3.0~3.5
C.4.0~4.5
D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图2所示).若该电池的总反应为LiCoO2+C6$\frac{\underline{\;充电\;}}{放电}$ CoO2+LiC6,则电池
放电时的正极反应式为CoO2+Li++e-=LiCoO2.

已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出加适量NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3 、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发(浓缩)、冷却(结晶)和过滤.
(5)萃取剂对金属离子的萃取率与pH的关系如图1.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B(填选项序号).

A.2.0~2.5
B.3.0~3.5
C.4.0~4.5
D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图2所示).若该电池的总反应为LiCoO2+C6$\frac{\underline{\;充电\;}}{放电}$ CoO2+LiC6,则电池
放电时的正极反应式为CoO2+Li++e-=LiCoO2.
18.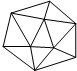 晶体硼的结构如图所示.已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子.下列有关说法不正确的是( )
晶体硼的结构如图所示.已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子.下列有关说法不正确的是( )
 晶体硼的结构如图所示.已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子.下列有关说法不正确的是( )
晶体硼的结构如图所示.已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子.下列有关说法不正确的是( )| A. | 每个硼分子含有12个硼原子 | B. | 晶体硼是空间网状结构 | ||
| C. | 晶体硼中键角是60° | D. | 每个硼分子含有30个硼硼单键 |
5.常温下,对下列四种溶液的叙述正确的是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 醋酸钠溶液 | 醋酸溶液 | 盐酸 |
| A. | ①、②两溶液相比,后者对水的电离的抑制程度大于前者 | |
| B. | ③、④两种溶液中分别加水稀释100倍,pH变化较大的是③ | |
| C. | 等体积的③、④溶液中分别加入过量锌粒,产生的氢气前者大于后者 | |
| D. | ①、④两溶液等体积混合后,溶液中微粒浓度满足c(NH4+)+c(NH3•H2O)=c(Cl-) |
3.为了除去氯化铝酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种过量的试剂,过滤后再加入适量盐酸.这种试剂是( )
| A. | 氨水 | B. | 氧化铝 | C. | 氢氧化钠 | D. | 氢氧化铁 |
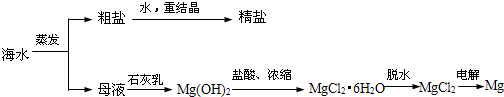
 水是一种重要的自然资源,是人类赖以生存、不可或缺的物质,水质的优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
水是一种重要的自然资源,是人类赖以生存、不可或缺的物质,水质的优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源. ;
; (R1、R2代表烃基或氩原子)
(R1、R2代表烃基或氩原子)
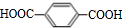 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;反应⑦的化学方程式为
+2H2O;反应⑦的化学方程式为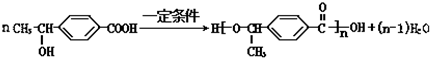 .
.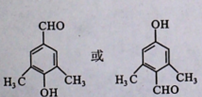 .
.