题目内容
2.等物质的量浓度的下列稀溶液:①CH3COONa溶液;②Na2CO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,则X溶液不可能是( )| A. | 氨水 | B. | 硅酸钠溶液 | C. | NaOH溶液 | D. | NaHCO3溶液 |
分析 若X为盐溶液,根据酸的酸性越弱,则对应盐的pH越大可知,X对应的酸的酸性比碳酸的酸性弱,若X为碱,则其碱性Ba(OH)2比弱.
解答 解:等物质的量浓度的下列稀溶液:①CH3COONa溶液;②Na2CO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,
X溶液的碱性大于碳酸钠,小于Ba(OH)2,
若X为盐溶液,根据酸的酸性越弱,则盐的pH越大可知,X对应的酸的酸性比碳酸的酸性弱,而硅酸的酸性比碳酸弱,故硅酸钠溶液符合;NaHCO3溶液的pH小于碳酸钠;
若X为碱,则其碱性Ba(OH)2比弱,可以是氨水、NaOH等;
故选D.
点评 本题考查了盐的水解,注意把握盐溶液pH的判断方法:酸的酸性越弱,则盐的pH越大,题目难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
10.去年下半年我省雾霾天气十分严重.PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放.通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO$\stackrel{催化剂}{→}$N2+CO2,下列关于此反应的说法中,不正确的是( )
| A. | 所涉及元素的第一电离能:N>O>C | |
| B. | 当x=2时,每生成1molN2,转移电子数为4mol | |
| C. | 等物质的量N2和C02中,π键的个数比为1:1 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
14.某有机物(分子式为C7Hx)完全燃烧时生成等物质的量的CO2与H2O,且能使溴的CCl4溶液褪色,若其结构中只含有两个-CH3,则该物质的结构(不考虑立体异构)最多有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 11种 |
12.将下列离子方程式改写成化学方程式,正确的是( )
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═H2O+CO2↑ BaCO3+2HCl═BaCl2+H2O+CO2↑ | |
| C. | Ca2++CO32-═CaCO3↓ Ca(OH)2+K2CO3═CaCO3↓+2KOH | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4+2H2O |
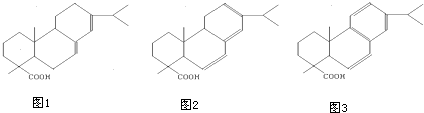
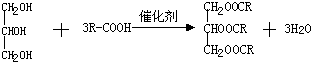 ;
;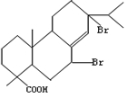 ;
;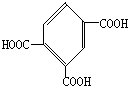 .
.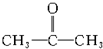 的官能团为
的官能团为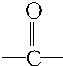 ,属于酮类物质,这两种物质的分子式为C3H6O,它们的关系是同分异构体.
,属于酮类物质,这两种物质的分子式为C3H6O,它们的关系是同分异构体.
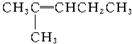
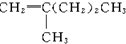
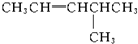
 的系统命名为:2,4-二甲基-3-乙基己烷.
的系统命名为:2,4-二甲基-3-乙基己烷. <
< (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同)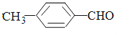 <
<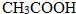 (提示:类比酚与醇的酸性)
(提示:类比酚与醇的酸性)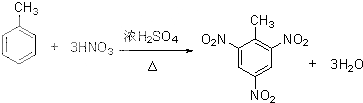 ;
; )在催化剂条件下,合成聚乳酸(PLA)的反应方程式:
)在催化剂条件下,合成聚乳酸(PLA)的反应方程式: .
.