题目内容
2.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0T1温度下的部分实验数据为
| t/s | 0 | 500 | 1000 | 1500 |
| C(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2 | |
| D. | 平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时C(N2O5)>5.00mol/L |
分析 A.依据图标数据分析计算500s内N2O5(g)消耗的浓度计算分解率;
B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,计算平衡浓度结合平衡常数概念计算平衡常数,根据转化率=$\frac{消耗量}{起始量}$×100%计算;
C.该反应正反应是吸热反应,升高温度,反应速率加快,平衡向正反应移动,平衡时时N2O5(g)浓度应降低;
D.体积减小,气体浓度增大,压强增大,平衡逆向进行.
解答 解:A.依据图标数据分析计算500s内N2O5(g)消耗的浓度=5.00mol/L-3.52mol/L=1.48mol/L,分解速率=$\frac{1.48mol/L}{500s}$=2.96×10-3 mol/(L•s),故A正确;
B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,c(NO2)=5mol/L,c(O2)=1.25mol/L,平衡常数K=$\frac{c({O}_{2}){c}^{4}(N{O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$=$\frac{1.25×{5}^{4}}{2.{5}^{2}}$=125,转化率为$\frac{5mol/L-2.5mol/L}{5mol/L}$×100%=50%,故B正确;
C.平衡常数只受温度影响,T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1>K2,反应吸热反应,则T1>T2,故C错误;
D.平衡后其他条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,压强增大,氨气浓度会增大一倍,反应前后气体体积增大,平衡逆向进行,则再平衡时C(N2O5)>5.00mol/L,故D正确;
故选:C.
点评 本题考查化学平衡状态判断、化学平衡有关计算、化学平衡影响因素、平衡常数等,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 无色试液加入Na2CO3溶液产生白色沉淀,结论:试液中含Ca2+ | |
| B. | 无色试液加入KOH溶液,加热产生的气体使湿润红色石蕊试纸变蓝,结论:试液中含NH4Cl | |
| C. | 无色试液使红色石蕊试纸变蓝,结论:试液呈碱性 | |
| D. | 无色试液焰色反应呈紫色,结论:试液是钾盐溶液 |
| A. | 1 L 1mol/L CH3COONa溶液中存在NA个CH3COO-离子 | |
| B. | 在标准状况下,22.4LSO3含有3NA个氧原子 | |
| C. | 1 mol Cl2参加化学反应获得的电子数都是2NA | |
| D. | 1 mol NO2气体降温后颜色变浅,其所含的原子数仍为3NA |
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:1:1 | D. | 1:1:1 |
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s).
(2)温度为T时,该反应的化学平衡常数=0.025.
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%.
要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
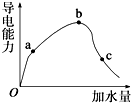 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: ,写出E的氢化物的分子式:H2O、H2O2.
,写出E的氢化物的分子式:H2O、H2O2.