题目内容
17.现有下列四组物质:①溴水、碘水;②溴水、溴化钾溶液;③碘水、碘化钾溶液;④氯水、氯化钾溶液(1)能用碘化钾淀粉试纸鉴别的是②③④
(2)能用淀粉溶液鉴别的是①③.
分析 (1)碘化钾中含有碘离子,碘离子能被强氧化剂氧化生成碘,碘遇淀粉试液变蓝色,所以只要能显示不同颜色的就能鉴别;
(2)碘遇淀粉试液变蓝色,只要一种物质含有碘单质一种物质不含碘单质就能鉴别.
解答 解:(1)①溴能氧化碘离子生成碘,碘水中含有碘,所以溴水和碘水都能使碘化钾淀粉试纸变蓝色,则无法鉴别;
②溴水能氧化碘离子生成碘而使淀粉碘化钾试纸变蓝色,溴化钾溶液和碘化钾不反应,所以不能使淀粉碘化钾试纸变蓝色,现象不同可以鉴别;
③碘水中含有碘而能使淀粉碘化钾试纸变蓝色、碘化钾溶液中不含碘单质而不能使碘化钾试纸变蓝色,现象不同,可以鉴别;
④氯水能氧化碘离子生成碘而使碘化钾淀粉试纸变蓝色,氯化钾溶液和碘化钾不反应而不能使碘化钾试纸变蓝色,现象不同,可以鉴别,
故答案为:②③④;
(2)①溴水中不含碘单质、碘水含有碘单质,所以溴水不能使淀粉试液变蓝色而碘水能使淀粉试液变蓝色,现象不同可以鉴别;
②溴水、溴化钾溶液都不含碘单质,都不能使淀粉试液变蓝色,现象相同无法鉴别;
③碘水中含有碘单质而使淀粉试液变蓝色、碘化钾溶液不含碘单质而不能使淀粉试液变蓝色,现象不同,可以鉴别;
④氯水、氯化钾溶液都不含碘单质,都不能使淀粉试液变蓝色,现象相同无法鉴别;
故选①③.
点评 本题考查物质鉴别实验方案设计,为高频考点,明确物质性质差异性是解本题关键,利用不同现象鉴别物质,题目难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
8.化合物HIn在水溶液中因存在以下电离平衡:HIn(红色)?H++In-(黄色) 故可用作酸碱指示剂,浓度为0.02mol•L-1的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤Na2CO3溶液 ⑥氨水 ⑦AlCl3溶液,其中能使指示剂显红色的是( )
| A. | ②⑤⑥ | B. | ①④⑤ | C. | ①④⑦ | D. | ①④⑤⑦ |
12.合成氨反应为N2+3H2≒2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )
| A. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| B. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| C. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 | |
| D. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 |
2.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
T1温度下的部分实验数据为
下列说法不正确的是( )
T1温度下的部分实验数据为
| t/s | 0 | 500 | 1000 | 1500 |
| C(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2 | |
| D. | 平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时C(N2O5)>5.00mol/L |
9.下列实验操作正确的是( )
| A. | 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | |
| B. | 蒸发时,加热到蒸发皿中出现较多量固体时停止加热 | |
| C. | 用分液漏斗分离液体时,先放出下层液体后,再放出上层液体 | |
| D. | 过滤时,用玻璃棒搅拌漏斗内的混合液以加快过滤速度 |
6.有一磷酸盐溶液,可能由Na3PO4、Na2HPO4或NaH2PO4或其中二者的混合物组成,今以酚酞为指示剂,用盐酸标准滴定溶液滴定至终点时消耗V1mL,再加入甲基红指示剂,继续用盐酸标准滴定溶液滴定至终点时消耗V2mL,当V2>V1,V1>0时,溶液的组成为( )
| A. | Na2HPO4+NaH2PO4 | B. | Na3PO4 | C. | NaH2PO4 | D. | Na3PO4+NaH2PO4 | ||||
| E. | Na3PO4+Na2HPO4 |
11. “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数.
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4+□K2SO4+□6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
①实验1条件下,反应从开始至达到平衡,以v(CO2) 表示的反应速率为0.13mol/(L•min)
(保留小数点后二位数,下同).
②实验2条件下平衡常数K=0.17,该反应为放热(填“吸热”或“放热”)反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
③H2O(g)═H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8KJ/mol.
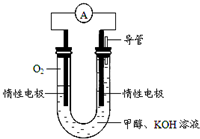
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应式为:O2+4e-+2H2O=4OH-;该电极上每消耗1.6g氧气,转移的电子数为0.2mol.
②该电池工作时,溶液中的OH-向负(填“正”或“负”)极移动.
 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数.
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4+□K2SO4+□6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
(保留小数点后二位数,下同).
②实验2条件下平衡常数K=0.17,该反应为放热(填“吸热”或“放热”)反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
③H2O(g)═H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8KJ/mol.
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应式为:O2+4e-+2H2O=4OH-;该电极上每消耗1.6g氧气,转移的电子数为0.2mol.
②该电池工作时,溶液中的OH-向负(填“正”或“负”)极移动.
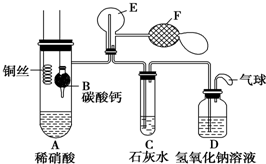 Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.