题目内容
14.下列事实中是什么因素影响了化学反应速率?①食品在夏天容易变质,冬天则不会出现该现象温度
②熔化的KClO3放出气泡很慢,撒入少量MnO2,会很快产生气体催化剂
③工业上常将固体燃料粉碎以提高燃烧效率接触面积
④同浓度等体积的硫酸与盐酸,和同样大小质量相等的锌粒反应,产生气体有快有慢氢离子浓度.
分析 影响反应速率的因素有:温度、浓度、压强、催化剂、反应物接触面积等,温度和催化剂是通过改变活化分子百分数来改变反应速率,浓度、压强是通过改变单位体积内活化分子个数来改变反应速率,据此分析解答.
解答 解:①夏天温度高于冬天,温度越高,活化分子百分数越大,其反应速率越大,所以食品在夏天容易变质,冬天则不会出现该现象,故答案为:温度;
②熔化的KClO3放出气泡很慢,撒入少量MnO2,会很快产生气体,二氧化锰在该反应中作催化剂,增大单位体积内活化分子百分数,所以反应速率增大,故答案为:催化剂;
③工业上常将固体燃料粉碎以提高燃烧效率,是通过增大反应物接触面积来改变反应速率,故答案为:接触面积;
④同浓度等体积的硫酸与盐酸,和同样大小质量相等的锌粒反应,产生气体有快有慢,硫酸中氢离子浓度大于盐酸,导致硫酸反应速率大于盐酸,故答案为:氢离子浓度.
点评 本题考查化学反应速率影响因素,为高频考点,明确温度、压强、浓度、催化剂、反应物接触面积对化学反应速率影响原理是解本题关键,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
4.下列在指定溶液中的各组离子,一定能够大量共存的是( )
| A. | 无色溶液中:CO32-、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:NH4+、K+、CH3COO-、Cl- | |
| C. | pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3- | |
| D. | 水电离的c(H+)=10-12 mol/L的溶液中:Fe3+、SO42-、K+、Na+ |
2.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
T1温度下的部分实验数据为
下列说法不正确的是( )
T1温度下的部分实验数据为
| t/s | 0 | 500 | 1000 | 1500 |
| C(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2 | |
| D. | 平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时C(N2O5)>5.00mol/L |
9.下列实验操作正确的是( )
| A. | 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | |
| B. | 蒸发时,加热到蒸发皿中出现较多量固体时停止加热 | |
| C. | 用分液漏斗分离液体时,先放出下层液体后,再放出上层液体 | |
| D. | 过滤时,用玻璃棒搅拌漏斗内的混合液以加快过滤速度 |
6.有一磷酸盐溶液,可能由Na3PO4、Na2HPO4或NaH2PO4或其中二者的混合物组成,今以酚酞为指示剂,用盐酸标准滴定溶液滴定至终点时消耗V1mL,再加入甲基红指示剂,继续用盐酸标准滴定溶液滴定至终点时消耗V2mL,当V2>V1,V1>0时,溶液的组成为( )
| A. | Na2HPO4+NaH2PO4 | B. | Na3PO4 | C. | NaH2PO4 | D. | Na3PO4+NaH2PO4 | ||||
| E. | Na3PO4+Na2HPO4 |
7.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是BC.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c (CO2)=c (CO)
(4)830℃下,若物质的浓度关系是c (CO2)•c (H2)>c (CO)•c (H2O),则此时正反应速率与逆反应速率的关系是a.
a.v正>v逆 b.v正=v逆 c.v正<v逆 d.无法判断
(5)830℃下,在2L密闭容器中,加入2mol CO2 和2mol H2,该温度下反应10分钟达到平衡,其平衡常数K=1.0,则10分钟内v (H2)=0.05 mol/(L•min),平衡时CO2的转化率为50%.
其化学平衡常数K和温度T的关系如下表:
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是BC.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c (CO2)=c (CO)
(4)830℃下,若物质的浓度关系是c (CO2)•c (H2)>c (CO)•c (H2O),则此时正反应速率与逆反应速率的关系是a.
a.v正>v逆 b.v正=v逆 c.v正<v逆 d.无法判断
(5)830℃下,在2L密闭容器中,加入2mol CO2 和2mol H2,该温度下反应10分钟达到平衡,其平衡常数K=1.0,则10分钟内v (H2)=0.05 mol/(L•min),平衡时CO2的转化率为50%.
8.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,8g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,下列热化学方程式正确的是C
A、$\frac{1}{4}$CH30H+$\frac{3}{8}$02=$\frac{1}{4}$C02+$\frac{1}{2}$H20△H=-113.5kJ•mol-1
B、$\frac{1}{4}$CH30H(l)+$\frac{3}{8}$02(g)=$\frac{1}{4}$C02(g)+$\frac{1}{2}$H20(l)△H=+113.5kJ•mol-1
C、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-908kJ•mol-1
D、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=+908kJ•mol-1
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2+3H2?NH3△H=a kJ•mol-1.试根据表中所列键能数据计算a的数值为-93.
(3)由金红石(TiO2)制备单质Ti,涉及的步骤为:TiO2-→TiCl4$→_{800℃,Ar}^{Mg}$Ti
已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H=-80kJ•mol-1.
(1)实验测得,8g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,下列热化学方程式正确的是C
A、$\frac{1}{4}$CH30H+$\frac{3}{8}$02=$\frac{1}{4}$C02+$\frac{1}{2}$H20△H=-113.5kJ•mol-1
B、$\frac{1}{4}$CH30H(l)+$\frac{3}{8}$02(g)=$\frac{1}{4}$C02(g)+$\frac{1}{2}$H20(l)△H=+113.5kJ•mol-1
C、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-908kJ•mol-1
D、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=+908kJ•mol-1
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(3)由金红石(TiO2)制备单质Ti,涉及的步骤为:TiO2-→TiCl4$→_{800℃,Ar}^{Mg}$Ti
已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H=-80kJ•mol-1.
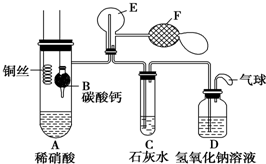 Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.