题目内容
【题目】某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL 0.55mol/L 的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1) 从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是_________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用20 mL 0.50 mol/L的盐酸跟20mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是______________;所求中和热的数值会________(填“相等”或“不相等”),理由是_________________。若他测得Δt=3℃,则中和热ΔH为_______________
【答案】环形玻璃搅拌棒保温、隔热,减少实验过程中的热量损失偏小不相等因为酸、碱发生中和反应放出的热量与酸、碱的用量有关相等中和热是指酸跟碱发生中和反应生成1mol H2O所放出的热量,它与酸、碱的用量无关-50.16kJ/mol
【解析】
(1).根据量热计的构造来判断该装置缺少的仪器;中和热测定实验成败的关键是保温工作;(2).不盖硬纸板,会有一部分热量散失;(3).反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来计算和解答。
(1).由量热计的构造可知该装置缺少的仪器是环形玻璃搅拌器;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热,减少实验过程中的热量损失,故答案为:环形玻璃搅拌棒;保温、隔热,减少实验过程中的热量损失;
(2).大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3).反应放出的热量和所用酸以及碱的量的多少有关,若用20mL0.50mol/L的盐酸跟20mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量减少,放出的热量偏少,但中和热是指酸和碱发生中和反应生成1mol水时放出的热,与酸碱的用量无关,所以改用20mL0.50mol/L的盐酸跟20mL0.55mol/L的NaOH溶液进行上述实验,测得中和热数值相等;△H=-[40g×4.18×10-3kJ/(g ·℃)×3℃]÷0.01mol=-50.16kJ/mol,故答案为:不相等;因为酸、碱发生中和反应放出的热量与酸、碱的用量有关;相等;中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,它与酸、碱的用量无关;-50.16kJ/mol。

 计算高手系列答案
计算高手系列答案【题目】依据题意,完成下列各题:
(1)1.0 g乙醇完全燃烧生成液态水放出1.37 kJ热量,表示乙醇的燃烧热的热化学方程式为__________________________________________________;
(2) “长征”2号火箭的发动机中用“偏二甲肼”(分子式为C2H8N2)和四氧化二氮作为液态燃料。已知a g偏二甲肼与b g四氧化二氮在发动机内燃烧生成稳定的、对环境友好的物质。若生成1 mol N2(g) 的反应热为c kJ,写出热化学方程式______________________________________________;
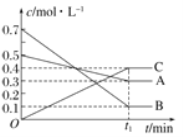
(3) T ℃时,如图所示, 对应的化学方程式为______________________;
(4) 向足量的H2SO4溶液中加入100 mL 0.4 mol·L-1的Ba(OH)2溶液,放出的热量是5.12 kJ。向足量的Ba(OH)2溶液中加入100 mL 0.4 mol·L-1的HCl溶液,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=______________;
(5) 研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P—P | P—O | O==O | P==O |
键能kJ/mol | 197 | 360 | 499 | x |
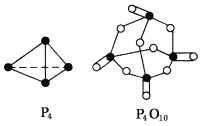
已知白磷(P4)的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=_________________。