题目内容
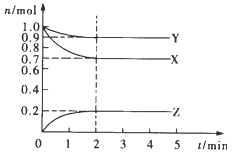
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气态物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为_________。反应开始至2 min,Z的平均反应速率为__________。
(2)甲烷作为能源燃烧放出大量的热,已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= -1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ/mol
则表示甲烷燃烧热的热化学方程式___________________________________________。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式),生成该沉淀的离子方程式为__________________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
(4)Na2S溶液具有较强的碱性,其原因为______________________。(用离子方程式表示)
【答案】3X+Y![]() 2Z 0.05mol/(L·min) CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol Cu(OH)2 Cu2+ +2NH3·H2O=Cu(OH)2 ↓+2NH4+ S2-+H2O
2Z 0.05mol/(L·min) CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol Cu(OH)2 Cu2+ +2NH3·H2O=Cu(OH)2 ↓+2NH4+ S2-+H2O ![]() HS-+OH-
HS-+OH-
【解析】
(1)由图象可知,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到2min时,X、Y的物质的量不变且不为0,属于可逆反应,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,参加反应的物质的物质的量之比等于化学计量数之比;根据υ=![]() ,计算v(Z);
,计算v(Z);
(2)根据燃烧热的概念,运用盖斯定律,就可以得到甲烷燃烧的热化学方程式;
(3) Mg(OH)2、Cu(OH)2的类型相同,根据溶度积常数越小,先形成沉淀判断;
(4)根据盐的组成,结合盐的水解规律分析判断。
(1)由图象可知,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到2min时,X、Y的物质的量不变且不为0,属于可逆反应,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,参加反应的物质的物质的量之比等于化学计量数之比,所以该反应的化学方程式为3X+Y![]() 2Z;根据方程式可知在2min内Z的物质的量增加了0.2mol,由于容器的容积为2L,则υ(Z)=
2Z;根据方程式可知在2min内Z的物质的量增加了0.2mol,由于容器的容积为2L,则υ(Z)=![]() =0.05mol/(Lmin);
=0.05mol/(Lmin);
(2)甲烷的燃烧热是101kPa时,1mol甲烷完全燃烧产生CO2气体和液态水时放出的热量。根据盖斯定律,将[①+②]÷2,整理可得:甲烷燃烧热的热化学方程式是:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol;
(3)由于Ksp[Mg(OH)2]=1.8×10-11>Ksp[Cu(OH)2]=2.2×10-20,Mg(OH)2、Cu(OH)2的类型相同,所以Cu(OH)2先生成沉淀;一水合氨是一元弱碱,与Cu2+结合形成Cu(OH)2沉淀,生成该沉淀的离子方程式为Cu2+ +2NH3·H2O=Cu(OH)2 ↓+2NH4+;
(4)Na2S是强碱弱酸盐,在溶液中,S2-发生水解反应,消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),使溶液具有较强的碱性,水解反应的离子方程式为:S2-+H2O ![]() HS-+OH-。
HS-+OH-。