��Ŀ����
����Ŀ������Ӧ�úʹ������Ļ��������������������Ҫ���塣
(1)����[CO(NH2)2]��һ�ָ�Ч���ʣ�Ҳ��һ�ֻ���ԭ�ϡ�
��������Ϊԭ����һ�������·�����Ӧ��
CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g)��H=+133.6 kJ/mol�����ڸ÷�Ӧ������˵����ȷ����______(�����)��
2NH3(g)+CO2(g)��H=+133.6 kJ/mol�����ڸ÷�Ӧ������˵����ȷ����______(�����)��
a���ӷ�Ӧ��ʼ��ƽ��ʱ�����л�������ƽ����Է����������ֲ���
b����ƽ����ϵ������ˮ��������ʹ�÷�Ӧ��ƽ�ⳣ������
c�������¶ȿ�ʹ���ص�ת��������
d. �ﵽƽ�����С�����������ƽ�����淴Ӧ�����ƶ�������ƽ��ʱNH3��Ũ�ȴ���ԭƽ��
��������һ�������¿ɽ����������ﻹԭΪ������
��֪��
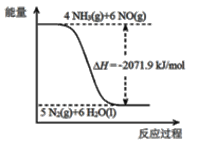
�ٽ�Ϣ��е���Ϣ����Ӧ2CO(NH2)2(s)+6NO(g)![]() 5N2(g)+2CO2(g)+4H2O(l)�ġ�H ��_______kJ/mol��
5N2(g)+2CO2(g)+4H2O(l)�ġ�H ��_______kJ/mol��
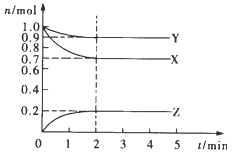
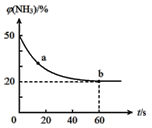
���ܱ��������Ե����ʵ�����NH3��CO2Ϊԭ�ϣ���120�桢���������·�Ӧ�������أ�CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)�����������NH3�����ʵ����ٷֺ�����ʱ��仯��ϵ��ͼ��ʾ��������ƽ��ת����Ϊ________________��
CO(NH2)2(s)+H2O(g)�����������NH3�����ʵ����ٷֺ�����ʱ��仯��ϵ��ͼ��ʾ��������ƽ��ת����Ϊ________________��
(2)NO2����Ⱦ����������Na2CO3��Һ����NO2������CO2����֪9.2g NO2��Na2CO3��Һ��ȫ��Ӧʱת�Ƶ���0.1mol��ǡ�÷�Ӧ��ʹ��Һ�е�CO2��ȫ�ݳ���������Һ�������ԣ�����Һ������Ũ�ȴ�С��ϵ��c(Na��)>______��
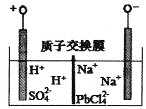
(3)����ȼ�ϵ��Ϊ��Դ��ͨ�����ӽ���Ĥ��ⷨ���Ƶ��Һ��OH����Ũ�����Ʊ�����Cu2O��װ����ͼ��ʾ��
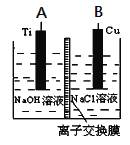
����װ����������ӦʽΪ________________________���õ����е����ӽ���ĤΪ________(����������������)���ӽ���Ĥ��
���𰸡�a -1804.7kJ/mol 75% c(NO3��)> c(NO2��)> c(OH��)>c(H��) 2Cu+2OH--2e-=Cu2O+H2O ��
��������
��1����a.��CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) ��H=+133.6 kJ/mol֪��Ӧ��������ɷ֣������л�������Ϊ�������ӷ�Ӧ��ʼ��ƽ��ʱ�����л�������ƽ����Է�����������(2
2NH3(g)+CO2(g) ��H=+133.6 kJ/mol֪��Ӧ��������ɷ֣������л�������Ϊ�������ӷ�Ӧ��ʼ��ƽ��ʱ�����л�������ƽ����Է�����������(2![]() ���䣬��a����ȷ��b. ��ѧ��Ӧʽ�й����Һ�岻д����ѧƽ�ⳣ������ʽ����CO(NH2)2(s)+H2O(l)
���䣬��a����ȷ��b. ��ѧ��Ӧʽ�й����Һ�岻д����ѧƽ�ⳣ������ʽ����CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g)��K=c2��NH3��.c(CO2)����Ӧ��ϵ��ˮ��״̬ΪҺ̬������ˮ���������ı�÷�Ӧ��ƽ�ⳣ������b�����c.�÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ������ص�ת���ʼ��٣���c�����;d. �ﵽƽ�����С�����������ƽ�����淴Ӧ�����ƶ�����Ϊ��Ӧ��������ɷ֣�������������Ϊ��������Դ���ƽ��ʱNH3��Ũ�Ȳ��䣬��D��������ȷ��Ϊa��
2NH3(g)+CO2(g)��K=c2��NH3��.c(CO2)����Ӧ��ϵ��ˮ��״̬ΪҺ̬������ˮ���������ı�÷�Ӧ��ƽ�ⳣ������b�����c.�÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ������ص�ת���ʼ��٣���c�����;d. �ﵽƽ�����С�����������ƽ�����淴Ӧ�����ƶ�����Ϊ��Ӧ��������ɷ֣�������������Ϊ��������Դ���ƽ��ʱNH3��Ũ�Ȳ��䣬��D��������ȷ��Ϊa��
�ڢ�.CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) ��H=+133.6 kJ/mol.�������仯ͼ��֪��.4 NH3(g)+6NO(g)=5N2(g)+ 6H2O(l)�� ��
2NH3(g)+CO2(g) ��H=+133.6 kJ/mol.�������仯ͼ��֪��.4 NH3(g)+6NO(g)=5N2(g)+ 6H2O(l)�� ��![]() 2+��ɵ�2CO(NH2)2(s)+6NO(g)
2+��ɵ�2CO(NH2)2(s)+6NO(g)![]() 5N2(g)+2CO2(g)+4H2O(l)�ġ�H ��-1804.7kJ/mol���𰸣�-1804.7kJ/mol��
5N2(g)+2CO2(g)+4H2O(l)�ġ�H ��-1804.7kJ/mol���𰸣�-1804.7kJ/mol��
����ͼ��֪����Ӧ��ʼʱ![]() ( NH3)=50
( NH3)=50![]() ����Ӧƽ��ʱ
����Ӧƽ��ʱ![]() ( NH3)=20
( NH3)=20![]() ���谱��Ͷ����Ϊ2a������ƽ��ת����Ϊx����
���谱��Ͷ����Ϊ2a������ƽ��ת����Ϊx����![]() ( NH3)=50
( NH3)=50![]() ��֪����Ӧǰ������̼Ͷ����Ϊ2a����Ӧƽ��ʱ�����ݷ���ʽ��֪�����İ���2ax�����Ķ�����̼ax������ˮ����ax������
��֪����Ӧǰ������̼Ͷ����Ϊ2a����Ӧƽ��ʱ�����ݷ���ʽ��֪�����İ���2ax�����Ķ�����̼ax������ˮ����ax������![]() (NH3)=20
(NH3)=20![]() �����е�ʽ
�����е�ʽ![]() (NH3)=n(NH3)/n(��)=(2a-2ax)/ [(2a-2ax)+ (2a-2ax)+ax]=20
(NH3)=n(NH3)/n(��)=(2a-2ax)/ [(2a-2ax)+ (2a-2ax)+ax]=20![]() �����x=75
�����x=75![]() ��������ƽ��ת����Ϊ75
��������ƽ��ת����Ϊ75![]() ���𰸣�75
���𰸣�75![]() ��
��
��2��9.2g NO2���ʵ���Ϊ0.2mol��NO2��Na2CO3��Һ���ղ�����CO2����Ӧת�Ƶ���0.1mol��̼�Ļ��ϼ۲�û�з����仯����ӦΪNO2������������ԭ��Ӧ��0.2mol NO2�����绯��Ӧת�Ƶ���0.1mol�����ݵ�ʧ�����غ㣬��N2��Ԫ�صĻ��ϼ�Ϊ+4��һ�뵪Ԫ������Ϊ+5��һ�뵪Ԫ�ؽ���Ϊ+3�����ӷ���ʽΪ2NO2 +CO32-=NO3-+NO2-+ CO2���ɻ�ѧ����ʽ��֪����ȫ��Ӧ������ΪNaNO3��NaNO2������HNO2Ϊ���ᣬNO2-����ˮ��ƽ��NO2-+H2O![]() OH-+ HNO2������Һ������Ũ�ȴ�С��ϵΪc(Na)>c(NO3��)> c(NO2��)> c(OH��)>c(H��) ;�𰸣�c(NO3��)> c(NO2��)> c(OH��)>c(H��) ��
OH-+ HNO2������Һ������Ũ�ȴ�С��ϵΪc(Na)>c(NO3��)> c(NO2��)> c(OH��)>c(H��) ;�𰸣�c(NO3��)> c(NO2��)> c(OH��)>c(H��) ��
(3)���ص�A��Ϊ��������H2O�õ��ӷ�����ԭ��Ӧ������OH-��B��Ϊ�������ɽ���ͭʧ���ӷ���������Ӧ��������Ӧʽ2Cu+2OH--2e-=Cu2O+H2O�����OH-����Cu2O��A������OH-��B������OH-���ʸ����ӽ���ĤΪ�����ӽ���Ĥ���𰸣� 2Cu+2OH--2e-=Cu2O+H2O������

����Ŀ���Դ�������ָ��Ӧ��֮һʹ�� ��Ӧ���ʼӿ�����á���ϡ�����ữ��![]() ������������ʵ�飬һ��ʱ�����Һ����ɫ��
������������ʵ�飬һ��ʱ�����Һ����ɫ��![]() ���Լ���
���Լ���![]() ����
����
ʵ��� | ʵ��� | ʵ��� |
|
|
|
��ɫ | ��ʵ�����ɫ�� | ��ʵ�����ɫ�� |
����˵������ȷ����
A.ʵ����з���������ԭ��Ӧ��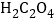 �ǻ�ԭ��������MnSO4�����Դ�����
�ǻ�ԭ��������MnSO4�����Դ�����
B.ʵ�����ɫ�Ȣٿ죬����ΪMnSO4�Ĵ����üӿ��˷�Ӧ����
C.ʵ�����ɫ�Ȣٿ죬����ΪCl-�Ĵ����üӿ��˷�Ӧ����
D.����![]() ��
��![]() ��ʵ��٣��Ʋ��ʵ�����ɫ��
��ʵ��٣��Ʋ��ʵ�����ɫ��