题目内容
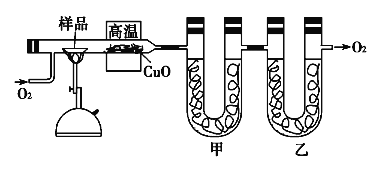
【题目】如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置。

(1)A是氯气发生装置,其中发生反应的离子方程式为___。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。则该反应的化学方程式为___。
(3)E装置这样设计的目的是防倒吸,除了防倒吸之外还有的作用是___。
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是___。
(5)若实验中使用12mol· L-1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是___。
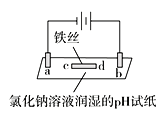
(6)某同学用如图的装置来验证氯气的有关性质:

①该同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因___。
②该同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是___,由此得出Cl2使有色物质褪色的机理是___。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 2Cl2+2H2O+C
Mn2++Cl2↑+2H2O 2Cl2+2H2O+C![]() CO2+4HCl 吸收Cl2和HCl气体,防止污染环境 储存多余的Cl2 随反应的进行盐酸变稀,与MnO2不反应 ②浓盐酸的挥发 Cl2被碱石灰吸收 干燥有色布条不褪色,而湿润有色布条褪色 Cl2与水反应生成HClO,而HClO具有漂白性
CO2+4HCl 吸收Cl2和HCl气体,防止污染环境 储存多余的Cl2 随反应的进行盐酸变稀,与MnO2不反应 ②浓盐酸的挥发 Cl2被碱石灰吸收 干燥有色布条不褪色,而湿润有色布条褪色 Cl2与水反应生成HClO,而HClO具有漂白性
【解析】
(1)A是氯气发生装置,药品为MnO2、浓盐酸,二者发生氧化还原反应,生成Cl2。
(2)D装置的硬质玻璃管内盛有炭粉,与带有水蒸气的氯气发生氧化还原反应,其产物为CO2和HCl。
(3)E装置这样设计的目的是防倒吸,除了防倒吸之外还有的作用是尾气处理。
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是将后来生成的氯气储存。
(5)若实验中使用12mol· L-1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,从氯化氢的挥发、仪器中存留、稀盐酸与MnO2不反应等方面进行分析。
(6)①该同学实验后并没有得到预期的实验现象,主要从Cl2有无进入广口瓶内分析原因。
②该同学在实验中使用干燥布条、潮湿布条,他预期的实验现象应为布条是否褪色,由此得出Cl2使有色物质褪色的机理是潮湿氯气中发生反应,生成物具有漂白性。
(1)A是氯气发生装置,药品为MnO2、浓盐酸,二者发生以下反应MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)D装置的硬质玻璃管内盛有炭粉,与带有水蒸气的氯气发生氧化还原反应2Cl2+2H2O+C![]() CO2+4HCl;答案为:2Cl2+2H2O+C
CO2+4HCl;答案为:2Cl2+2H2O+C![]() CO2+4HCl;
CO2+4HCl;
(3)E装置这样设计的目的是防倒吸,除了防倒吸之外还有的作用是吸收Cl2和HCl气体,防止污染环境;答案为:吸收Cl2和HCl气体,防止污染环境;
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是储存多余的Cl2;答案为:储存多余的Cl2;
(5)若实验中使用12mol· L-1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,其可能原因是①随反应的进行盐酸变稀,与MnO2不反应 ②浓盐酸的挥发;答案为:①随反应的进行盐酸变稀,与MnO2不反应 ②浓盐酸的挥发;
(6)①该同学实验后并没有得到预期的实验现象,主要是Cl2被碱石灰吸收;答案为:Cl2被碱石灰吸收;
②该同学在实验中使用干燥布条、潮湿布条,他预期的实验现象应为干燥有色布条不褪色,而湿润有色布条褪色,由此得出Cl2使有色物质褪色的机理是Cl2与水反应生成HClO,而HClO具有漂白性。答案为:干燥有色布条不褪色,而湿润有色布条褪色;Cl2与水反应生成HClO,而HClO具有漂白性。

【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,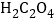 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快