题目内容
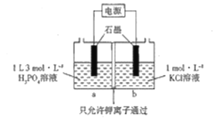
【题目】25°C, 在 0. 1 mol L-1 的CH3COOH 溶液中滴加 NaOH溶液,溶液中c(CH3COOH)、c(CH3COO-)与 pH的关系如图所示。下列叙述正确的是
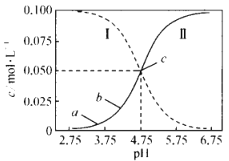
A.曲线I表示混合溶液中c(CH3COO-)随pH变化关系
B.a点溶液的导电能力比b点的强
C.25℃时,CH3COOH的电离平衡常数为10-4.75
D.pH=5.5的溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)
【答案】C
【解析】
在 0. 1 mol L-1 的CH3COOH 溶液中滴加 NaOH溶液,CH3COOH溶液逐渐转化为CH3COONa的溶液,随NaOH溶液滴加,溶液pH逐渐增大,c(CH3COOH)逐渐减小,c(CH3COO-)逐渐增大,则曲线I表示c(CH3COOH) 随pH变化关系,曲线Ⅱ表示c(CH3COO-)随pH变化关系,据此分析解答。
A.根据分析,曲线Ⅱ表示混合溶液中c(CH3COO-)随pH变化关系,故A错误;
B.a、b点均在曲线Ⅱ上,从a到b溶液的c(CH3COO-)浓度增大,c(CH3COOH)逐渐减小,溶液中离子的含量最多,导电能力增强,则a点溶液的导电能力比b点的若,故B错误;
C.25℃时,CH3COOH的电离平衡常数表达式为:Ka=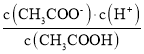 ,c点时,c(CH3COO-)= c(CH3COOH),溶液pH=4.75,即溶液中c(H+)=10-4.75mol/L,则Ka=c(H+)=10-4.75mol/L,故C正确;
,c点时,c(CH3COO-)= c(CH3COOH),溶液pH=4.75,即溶液中c(H+)=10-4.75mol/L,则Ka=c(H+)=10-4.75mol/L,故C正确;
D.由图像可知,pH=5.5的溶液中,c(CH3COO-)>c(CH3COOH),溶液中存在电荷守恒:c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),溶液显酸性,则c(H+)>c(OH-),因此c(Na+)<c(CH3COO-),故D错误;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案