题目内容
【题目】磷酸二氢钾(KH2PO4)是一种大型非线性光学晶体,在未来能源领域——“人造太阳”计划中有重要作用.以氯磷灰石(主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质)为原料制备KH2PO4的一种工艺流程如图所示:
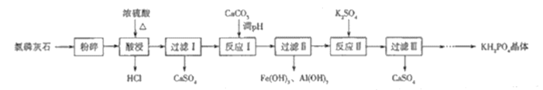
已知:①离子完全沉淀时的pH为Fe3+:3.5,Al3+:5.2.
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水
(1)已知“酸浸”时发生反应的化学方程式为![]() ,该反应体现了浓硫酸的______________________性和___________________性.
,该反应体现了浓硫酸的______________________性和___________________性.
(2)如果将原料改为氟磷灰石,则“酸浸”时不能使用玻璃容器,原因是______________________.
(3)“反应Ⅱ”的化学方程式为________________________________________.
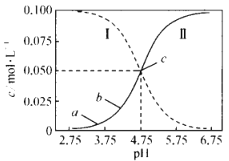
(4)常温下磷酸的电离平衡常数![]() 、
、![]() 、
、![]() ,
,![]() 的电离常数
的电离常数![]() 、
、![]() ,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
(5)KH2PO4也可以通过如图所示装置电解制备:
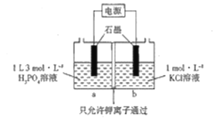
则阳极的电极反应式为___________________.假如通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为__________________g.
【答案】强酸 难挥发 生成的HF会与玻璃中的SiO2反应 K2SO4+Ca(H2PO4)2=2KH2PO4+CaSO4↓ 酸性 H3PO4+2CO![]() =HPO
=HPO![]() +2HCO
+2HCO![]() +H2O 2Clˉ-2eˉ=Cl2↑ 225g
+H2O 2Clˉ-2eˉ=Cl2↑ 225g
【解析】
氯磷灰石[主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质]粉碎,加入浓硫酸酸浸,并加热,生成HCl气体,过滤得到微溶物硫酸钙,滤液含有磷酸、硫酸铁、硫酸铝等,加入碳酸钙调节pH,生成氢氧化铝、氢氧化铁沉淀,过滤在得到的滤液中加入硫酸钾,生成硫酸钙,同时生成KH2PO4,经系列操作得到KH2PO4晶体,以此解答该题。
(1)该反应中生成磷酸体现了浓硫酸的强酸性,生成HCl体现了浓硫酸的难挥发性;
(2)根据酸浸时发生的反应可知若将原料改为氟磷灰石会生成HF,而HF会与玻璃中的SiO2发生反应,所以不能使用玻璃容器;
(3)根据所给条件“Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水”可知加入硫酸钾前溶液中的溶质主要为Ca(H2PO4)2,所以“反应II”的化学方程式为K2SO4+Ca(H2PO4)2=2KH2PO4+CaSO4↓;
(4)KH2PO4溶液中存在H2PO![]() 的电离和水解,其电离平衡常数为Ka2=6.3×10-8,其水解平衡常数Kh=
的电离和水解,其电离平衡常数为Ka2=6.3×10-8,其水解平衡常数Kh=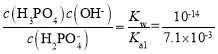 =1.4×10-12<6.3×10-8,即电离程度更大,所以溶液显酸性;根据题意可知酸性:H3PO4>H2CO3>H2PO
=1.4×10-12<6.3×10-8,即电离程度更大,所以溶液显酸性;根据题意可知酸性:H3PO4>H2CO3>H2PO![]() >HCO
>HCO![]() >HPO
>HPO![]() ,所以将少量磷酸滴入碳酸钠溶液中反应的离子方程式为H3PO4+2CO
,所以将少量磷酸滴入碳酸钠溶液中反应的离子方程式为H3PO4+2CO![]() =HPO
=HPO![]() +2HCO
+2HCO![]() +H2O;
+H2O;
(5)该装置需要制备KH2PO4,所以电解过程中钾离子要向左侧移动,则左侧为阴极,右侧为阳极,阳极的电解质溶液为KCl溶液,所以氯离子在阳极放电生成氯气,电极反应式为:2Clˉ-2eˉ=Cl2↑;左侧为阴极,氢离子放电生成氢气,电极反应式为2H++2eˉ=H2↑,通电前两室质量相等,若有2NA个K+通过交换膜,即右室有2molK+进入左室,根据电极反应式可知同时右室生成1mol氯气,左室生成1mol氢气,则两室溶液的质量差为39g/mol×4mol+71g/mol×1mol-2g/mol×1mol=225g。