题目内容
【题目】现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
①向溶液中加入1~2滴指示剂 ②取20mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点 ④重复以上操作
⑤用天平精确称取5.105g邻苯二甲酸氢钾(相对分子质量为204.2)固体配成250mL标准溶液(测得pH约为4.2).
⑥根据实验数据计算氢氧化钠的物质的量浓度.
(1)以上各步中,正确的(填序号)操作顺序是__,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是__.选用指示剂是:__
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为:V(NaOH)=![]() =20.20mL,他的计算合理吗?理由是____,通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a____20.02(填“>”、“<”或“=”)
=20.20mL,他的计算合理吗?理由是____,通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a____20.02(填“>”、“<”或“=”)

(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作__.
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果__(填“偏大”、“偏小”或“无影响”)
【答案】⑤②①③④⑥ 酸式滴定管 酚酞 不合理,第3组数据和其他三组相差较大,应舍去 < 快速放液 偏小
【解析】
(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液、滴定等顺序操作,则操作顺序为⑤②①③④⑥;标准液为邻苯二甲酸氢钾溶液,显酸性,取20mL标准液时需要使用酸式滴定管,滴定到终点,溶液显碱性,根据滴定终点的pH要在指示剂的变色范围之内,需要的指示剂为酚酞;
(2)他的计算不合理,因为第三组数值与其余数值相差较大,应舍去。消耗NaOH的体积的平均值为(19.98+20.00+20.02)/2=20.00mL;根据图像,a点pH=7,溶液为中性,邻苯二甲酸氢钾略过量,还没有到达滴定终点,第4组的滴定终点的读数为20.02mL,所以a<20.02mL;
(3)观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作快速放液;
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测的氢氧化钠溶液滴定,氢氧化钠溶液被稀释,所测氢氧化钠的浓度偏小。

【题目】富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:

已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
(1)上述流程中能加快反应速率的措施有______、_______等。
(2)酸浸时发生反应:2MgO·SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O,2MgO·B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4。
①上述反应体现出酸性强弱:H2SO4______H3BO3(填“>”或“<”)。
② 酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:______、______。
③ 已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3 + OH- B(OH)4-。下列关于硼酸的说法正确的是__(填序号)。
a. 硼酸是一元酸
b. 向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
c. 硼酸的电离方程式可表示为:H3BO3 + H2O![]() B(OH)4-+H+
B(OH)4-+H+
(3)检验褐色浸出液中的杂质离子:取少量浸出液,______(填操作和现象),证明溶液中含有Fe2+。
(4)除去浸出液中的杂质离子: 用MgO调节溶液的pH至______以上,使杂质离子转化为______(填化学式)沉淀,过滤。
(5)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合下图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,______(将方法补充完整)。

【题目】KIO3 是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3 氧化法”制备 KIO3 工艺流程如下图所示,回答下列问题:
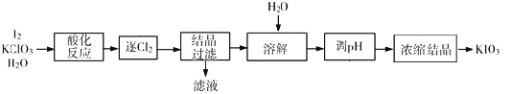
(1)“酸化反应”所得产物有 KH(IO3)2、Cl2 和 KCl。“逐 Cl2”采用的方法是________;
(2)“滤液”中的溶质主要是_______;“调 pH”中发生反应的化学方程式为_____________________;
(3)结晶过滤时工人发现 KH(IO3)2 为悬浮絮状沉淀,以下可以采用的方法是________;
A.倾析法 B.重结晶法 C.抽滤法 D. 离心分离法
(4)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂 X 调整反应后溶液的 pH,对生产碘酸钾有什么具体影响_________________________________________________________________;
(5)KIO3 也可采用“电解法”制备,装置如图所示。与“电解法”相比,“KClO3 氧化法”的主要不足之处有_____________________________________;(写出一点)

(6)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取 w g 食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量 KI 溶液,使 KIO3 与 KI 反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1 的 Na2S2O3 溶液 10.0mL 恰好反应。 则加碘食盐样品中的碘元素含量是______________mg/kg;(以含 w 的代数式表示)
(7)学生乙又对纯净的 NaCl(不含 KIO3)进行了下列实验:
操作步骤 | 实验现象 |
取 1g 纯净的 NaCl,加 3mL 水配成溶液。 | 溶液无变化 |
滴入 5 滴淀粉溶液和 1mL 0.1 mol·L-1KI 溶液,振荡。 | 溶液无变化 |
然后再滴入 1 滴 1mol·L-1 的 H2SO4,振荡。 | 溶液变蓝色 |
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价___________________________。
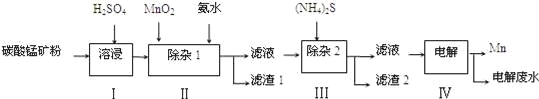
【题目】锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10﹣13 | 3.0×10﹣16 | 5.0×10﹣16 | 1.0×10﹣11 | 5.0×10﹣22 | 1.0×10﹣22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 ;
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ ;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ;
加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有 ;滤渣2的主要成分是 ;
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10﹣5molL﹣1,则应保持溶液中c(S2﹣)≥ molL﹣1.

