题目内容
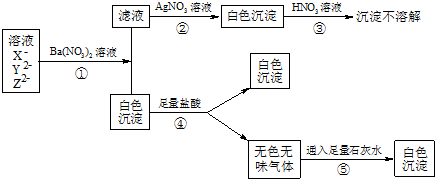
7.已知某治疗缺铁性贫血药剂的有效成分是硫酸亚铁,请设计实验方案证明药剂中含有Fe2+、SO42-,写出实验步骤、实验现象及结论.将药剂研碎,加适量水溶解,振荡,取上层清液,加足量的稀盐酸,再滴入几滴氯化钡溶液,若加盐酸无沉淀,加氯化钡溶液有白色沉淀生成,则说明药剂中含有SO42-、同上,再取上层清液,先加2~3滴KSCN,后加氯水,若开始时无现象,后溶液呈血红色,则说明药剂中含有亚铁离子;若将药剂研碎溶于水后,发现溶液呈浅黄色,则溶液中可能含有什么离子?请设计实验证明溶液中是否存在该离子.取溶液少量,滴入2~3滴KSCN,若溶液呈血红色,则浅黄色溶液中含有Fe3+;若要将Fe2+全部转化为该离子,又不增加溶液组成元素的种类,则实现该反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.分析 用稀盐酸和氯化钡溶液检验溶液中是否含有SO42-;用硫氰化铁和氯水检验亚铁离子;将药剂研碎溶于水后,发现溶液呈浅黄色,则溶液中可能含有Fe3+,检验方法为取溶液少量,滴入2~3滴KSCN,若溶液呈血红色,溶液中含有Fe3+;用双氧水可将亚铁离子氧化成铁离子,且不会增加溶液元素种类.
解答 解:证明药剂中含有SO42-的方法为:将药剂研碎,加适量水溶解,振荡,取上层清液,加足量的稀盐酸,再滴入几滴氯化钡溶液,若加盐酸无沉淀,加氯化钡溶液有白色沉淀生成,则说明药剂中含有SO42-;
证明药剂中含有Fe2+的方法为:将药剂研碎,加适量水溶解,振荡,再取上层清液,先加2~3滴KSCN,后加氯水,若开始时无现象,后溶液呈血红色,则说明药剂中含有亚铁离子;
若将药剂研碎溶于水后,发现溶液呈浅黄色,则溶液中可能含有Fe3+,检验方法为取溶液少量,滴入2~3滴KSCN,若溶液呈血红色,则浅黄色溶液中含有Fe3+;
亚铁离子具有还原性,能够被双氧水氧化呈铁离子,且没有增加溶液元素种类,反应的化学方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:将药剂研碎,加适量水溶解,振荡,取上层清液,加足量的稀盐酸,再滴入几滴氯化钡溶液,若加盐酸无沉淀,加氯化钡溶液有白色沉淀生成,则说明药剂中含有SO42-;同上,再取上层清液,先加2~3滴KSCN,后加氯水,若开始时无现象,后溶液呈血红色,则说明药剂中含有亚铁离子;取溶液少量,滴入2~3滴KSCN,若溶液呈血红色,则浅黄色溶液中含有Fe3+;2Fe2++2H++H2O2=2Fe3++2H2O.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题培养了学生的分析能力及灵活应用能力.

| A. | 摩尔是一种国际基本物理量 | |
| B. | 在同温同压下,相同体积的任何气体单质所含分子数相同 | |
| C. | 标准状况下气体摩尔体积约为22.4 L | |
| D. | 1 mol氧的质量为16 g |
| A. | 由反应可确定:氧化性HClO3<O2 | |
| B. | 由非金属性Cl>S,可推知酸性HClO3>H2SO4 | |
| C. | 若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3=2O2↑+C12↑+HClO4+H2O | |
| D. | 若化学计量数a=8,b=3,则该反应转移电子数为10e- |
| A. | 1H核磁共振法 | B. | 铜丝燃烧法 | C. | 李比希燃烧法 | D. | 元素分析仪 |
| A. | ZnO | B. | K2CO3 | C. | Zn(OH)2 | D. | ZnCO3 |
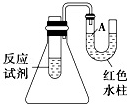 (1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:
(1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题: