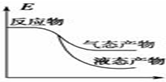
题目内容
2.已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ•mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.分析 正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量,由此分析解答.
解答 解:设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-436kJ-151kJ=11kJ,解得x=299,故答案为:299.
点评 本题考查反应热的有关计算、键能与反应热的关系等,题目难度中等,明确“化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量”解题的关键,注意反应热与键能的计算关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.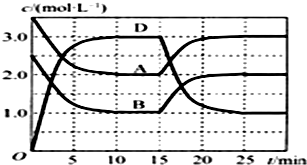 温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
 温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )| A. | 该反应的平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| C. | 反应至15 min时,改变的条件是升高温度 | |
| D. | 反应在前10 min的平均反应速率:v(D)=0.3 mol•L-1•min-1 |
17.下列离子方程式正确的是( )
| A. | 向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-=CO2↑+H2O | |
| C. | 向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ | |
| D. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32- |
14.海波(Na2S2O3•5H2O)可用作脱氯剂、定影剂、解毒剂.硫粉和亚硫酸钠溶液煮沸可得Na2S2O3•5H2O.海波的部分性质如下:易溶于水,不溶于乙醇;熔点48.2℃;在潮湿的空气中易潮解.请回答下列有关实验问题:
(Ⅰ)海波的制取
实验室制备海波过程如下:
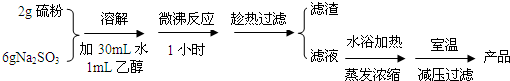
(1)操作中趁热过滤的原因是防止温度降低时海波的析出,以减少海波的损失.
(2)减压过滤后所得初产品需经过洗涤、干燥,洗涤液采用乙醇,而不用蒸馏水或稀硫酸的原因是海波不溶于乙醇、硫代硫酸钠能溶于蒸馏水(硫不溶于蒸馏水)、硫代硫酸钠能与硫酸反应(S2O32-+2H+=S↓+SO2↑+H2O).

参照丁图简述对海波晶体洗涤的方法关小水龙头,加入乙醇没过产物,让乙醇慢慢通过晶体.
(Ⅱ)海波纯度的测定
碘水滴定硫代硫酸钠的反应原理为:I2+2S2O32-═2I-+S4O62-.某同学用干燥的锥形瓶称取产品ag,向锥形瓶中加适量的蒸馏水使其溶解,再滴加适量淀粉溶液作为指示剂,然后用c mol•L-1的标准碘水滴定,当达到滴定终点时,消耗VmL标准碘水.
(3)判断滴定终点时的现象为当滴加最后一滴标准碘液时,锥形瓶中溶液的颜色由无色变为蓝色且半分钟内不褪色.
(4)该海波(Na2S2O3•5H2O)样品的纯度为$\frac{49.6cV}{a}$%.
(5)下列因素中,导致滴定结果偏高的是BC.
A.锥形瓶未干燥
B.滴定管经水洗后末用标准液润洗
C.滴定前平视,滴定后仰视
D.滴定前,滴定管中的液面处于“0”刻度以下
(Ⅲ)实验探究
探究一:为探究外界条件对化学反应速率的影响因素,取一部分产品与稀硫酸发生反应设计了以下四组实验:
(6)上述四组实验中通过两两比较,能够得出反应速率影响因素的实验组合有4组.
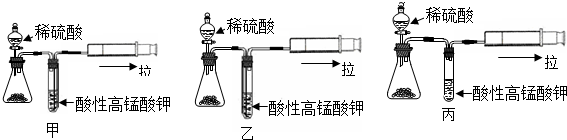
探究二:取一部分初产品与稀硫酸反应,为检验实验过程中产生的SO2气体,设计了如图甲、乙和丙的探究装置.
(7)上述装置中最合理的是乙(填“甲”或“乙”或“丙”),写出检验SO2的离子反应方程式5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
(Ⅰ)海波的制取
实验室制备海波过程如下:

(1)操作中趁热过滤的原因是防止温度降低时海波的析出,以减少海波的损失.
(2)减压过滤后所得初产品需经过洗涤、干燥,洗涤液采用乙醇,而不用蒸馏水或稀硫酸的原因是海波不溶于乙醇、硫代硫酸钠能溶于蒸馏水(硫不溶于蒸馏水)、硫代硫酸钠能与硫酸反应(S2O32-+2H+=S↓+SO2↑+H2O).

参照丁图简述对海波晶体洗涤的方法关小水龙头,加入乙醇没过产物,让乙醇慢慢通过晶体.
(Ⅱ)海波纯度的测定
碘水滴定硫代硫酸钠的反应原理为:I2+2S2O32-═2I-+S4O62-.某同学用干燥的锥形瓶称取产品ag,向锥形瓶中加适量的蒸馏水使其溶解,再滴加适量淀粉溶液作为指示剂,然后用c mol•L-1的标准碘水滴定,当达到滴定终点时,消耗VmL标准碘水.
(3)判断滴定终点时的现象为当滴加最后一滴标准碘液时,锥形瓶中溶液的颜色由无色变为蓝色且半分钟内不褪色.
(4)该海波(Na2S2O3•5H2O)样品的纯度为$\frac{49.6cV}{a}$%.
(5)下列因素中,导致滴定结果偏高的是BC.
A.锥形瓶未干燥
B.滴定管经水洗后末用标准液润洗
C.滴定前平视,滴定后仰视
D.滴定前,滴定管中的液面处于“0”刻度以下
(Ⅲ)实验探究
探究一:为探究外界条件对化学反应速率的影响因素,取一部分产品与稀硫酸发生反应设计了以下四组实验:
| 组号 | 反应温度(℃) | Na2S2O3 | H2O | H2SO4 | ||
| V/mL | c/mol•L-1 | V/mL | V/mL | c/mol•L-1 | ||
| ① | 10 | 10 | 0.1 | 0 | 10 | 0.1 |
| ② | 10 | 5 | 0.1 | 5 | 10 | 0.1 |
| ③ | 30 | 10 | 0.1 | 0 | 10 | 0.1 |
| ④ | 30 | 5 | 0.1 | 5 | 10 | 0.1 |

探究二:取一部分初产品与稀硫酸反应,为检验实验过程中产生的SO2气体,设计了如图甲、乙和丙的探究装置.
(7)上述装置中最合理的是乙(填“甲”或“乙”或“丙”),写出检验SO2的离子反应方程式5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
11.2015年7月19日央视《每周质量报告》曝光,近9成EVA儿童地垫含甲酰胺(结构简式 ),EVA
),EVA
材质是乙烯一醋酸乙烯共聚物材质.甲酰胺有生殖毒性,180℃开始部分分解生成CO和NH3,伤害眼睛、皮肤黏膜.下列说法正确的是.
 ),EVA
),EVA材质是乙烯一醋酸乙烯共聚物材质.甲酰胺有生殖毒性,180℃开始部分分解生成CO和NH3,伤害眼睛、皮肤黏膜.下列说法正确的是.
| A. | EVA材质属于高分子化合物材质 | |
| B. | NH3溶于水能导电,所以NH3是电解质 | |
| C. | 甲酰胺的摩尔质量为45 | |
| D. | 甲酰胺分解生成CO和NH3属于氧化还原反应 |