题目内容
19.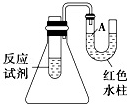 (1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:
(1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:①将生石灰加入小试管内,然后注入足量水,有关反应的化学方程式是CaO+H2O=Ca(OH)2.
②U形导管中液面A下降(填“上升”或“下降”),说明此反应是放热(填“吸热”或“放热”)反应.
(2)写出下列可逆反应的平衡常数表达式.
①2NO(g)+2CO(g) 2CO2(g)+N2(g)△H<0K=$\frac{c(CO{\;}_{2}){\;}^{2}}{C(NO){\;}^{2}C(CO){\;}^{2}}$
②C(s)+CO2(g) 2CO(g)△H>0K=$\frac{c(CO){\;}^{2}}{c(CO{\;}_{2})}$.
分析 (1)①生石灰加入小试管内,然后注入足量水,发生反应生成氢氧化钙;
②生石灰与水的反应为放热反应,反应放出的热量使气体膨胀;
(2)根据平衡常数的表达式等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积书写.
解答 解:(1)生石灰加入小试管内,然后注入足量水,发生反应生成氢氧化钙,方程式为CaO+H2O=Ca(OH)2,故答案为:CaO+H2O=Ca(OH)2;
②生石灰与水的反应为放热反应,反应放出的热量使气体膨胀,使U形管液面A下降,故答案为:下降;放热;
(2)①2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0,K=$\frac{c(CO{\;}_{2}){\;}^{2}}{C(NO){\;}^{2}C(CO){\;}^{2}}$,故答案为:K=$\frac{c(CO{\;}_{2}){\;}^{2}}{C(NO){\;}^{2}C(CO){\;}^{2}}$;
②C(s)+CO2(g)?2CO(g)△H>0,K=$\frac{c(CO){\;}^{2}}{c(CO{\;}_{2})}$,故答案为:K=$\frac{c(CO){\;}^{2}}{c(CO{\;}_{2})}$;
点评 本题考查吸热反应和放热反应以及平衡常数表达式的书写,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列离子方程式书写正确的是( )
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| B. | NH4HCO3溶液与足量NaOH溶液混合加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O | |
| C. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
10.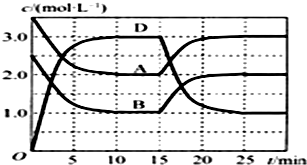 温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
 温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )| A. | 该反应的平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| C. | 反应至15 min时,改变的条件是升高温度 | |
| D. | 反应在前10 min的平均反应速率:v(D)=0.3 mol•L-1•min-1 |
14.海波(Na2S2O3•5H2O)可用作脱氯剂、定影剂、解毒剂.硫粉和亚硫酸钠溶液煮沸可得Na2S2O3•5H2O.海波的部分性质如下:易溶于水,不溶于乙醇;熔点48.2℃;在潮湿的空气中易潮解.请回答下列有关实验问题:
(Ⅰ)海波的制取
实验室制备海波过程如下:
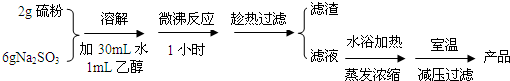
(1)操作中趁热过滤的原因是防止温度降低时海波的析出,以减少海波的损失.
(2)减压过滤后所得初产品需经过洗涤、干燥,洗涤液采用乙醇,而不用蒸馏水或稀硫酸的原因是海波不溶于乙醇、硫代硫酸钠能溶于蒸馏水(硫不溶于蒸馏水)、硫代硫酸钠能与硫酸反应(S2O32-+2H+=S↓+SO2↑+H2O).

参照丁图简述对海波晶体洗涤的方法关小水龙头,加入乙醇没过产物,让乙醇慢慢通过晶体.
(Ⅱ)海波纯度的测定
碘水滴定硫代硫酸钠的反应原理为:I2+2S2O32-═2I-+S4O62-.某同学用干燥的锥形瓶称取产品ag,向锥形瓶中加适量的蒸馏水使其溶解,再滴加适量淀粉溶液作为指示剂,然后用c mol•L-1的标准碘水滴定,当达到滴定终点时,消耗VmL标准碘水.
(3)判断滴定终点时的现象为当滴加最后一滴标准碘液时,锥形瓶中溶液的颜色由无色变为蓝色且半分钟内不褪色.
(4)该海波(Na2S2O3•5H2O)样品的纯度为$\frac{49.6cV}{a}$%.
(5)下列因素中,导致滴定结果偏高的是BC.
A.锥形瓶未干燥
B.滴定管经水洗后末用标准液润洗
C.滴定前平视,滴定后仰视
D.滴定前,滴定管中的液面处于“0”刻度以下
(Ⅲ)实验探究
探究一:为探究外界条件对化学反应速率的影响因素,取一部分产品与稀硫酸发生反应设计了以下四组实验:
(6)上述四组实验中通过两两比较,能够得出反应速率影响因素的实验组合有4组.
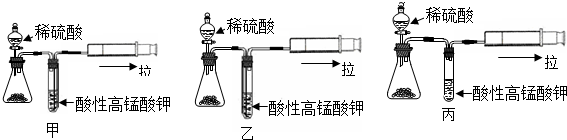
探究二:取一部分初产品与稀硫酸反应,为检验实验过程中产生的SO2气体,设计了如图甲、乙和丙的探究装置.
(7)上述装置中最合理的是乙(填“甲”或“乙”或“丙”),写出检验SO2的离子反应方程式5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
(Ⅰ)海波的制取
实验室制备海波过程如下:

(1)操作中趁热过滤的原因是防止温度降低时海波的析出,以减少海波的损失.
(2)减压过滤后所得初产品需经过洗涤、干燥,洗涤液采用乙醇,而不用蒸馏水或稀硫酸的原因是海波不溶于乙醇、硫代硫酸钠能溶于蒸馏水(硫不溶于蒸馏水)、硫代硫酸钠能与硫酸反应(S2O32-+2H+=S↓+SO2↑+H2O).

参照丁图简述对海波晶体洗涤的方法关小水龙头,加入乙醇没过产物,让乙醇慢慢通过晶体.
(Ⅱ)海波纯度的测定
碘水滴定硫代硫酸钠的反应原理为:I2+2S2O32-═2I-+S4O62-.某同学用干燥的锥形瓶称取产品ag,向锥形瓶中加适量的蒸馏水使其溶解,再滴加适量淀粉溶液作为指示剂,然后用c mol•L-1的标准碘水滴定,当达到滴定终点时,消耗VmL标准碘水.
(3)判断滴定终点时的现象为当滴加最后一滴标准碘液时,锥形瓶中溶液的颜色由无色变为蓝色且半分钟内不褪色.
(4)该海波(Na2S2O3•5H2O)样品的纯度为$\frac{49.6cV}{a}$%.
(5)下列因素中,导致滴定结果偏高的是BC.
A.锥形瓶未干燥
B.滴定管经水洗后末用标准液润洗
C.滴定前平视,滴定后仰视
D.滴定前,滴定管中的液面处于“0”刻度以下
(Ⅲ)实验探究
探究一:为探究外界条件对化学反应速率的影响因素,取一部分产品与稀硫酸发生反应设计了以下四组实验:
| 组号 | 反应温度(℃) | Na2S2O3 | H2O | H2SO4 | ||
| V/mL | c/mol•L-1 | V/mL | V/mL | c/mol•L-1 | ||
| ① | 10 | 10 | 0.1 | 0 | 10 | 0.1 |
| ② | 10 | 5 | 0.1 | 5 | 10 | 0.1 |
| ③ | 30 | 10 | 0.1 | 0 | 10 | 0.1 |
| ④ | 30 | 5 | 0.1 | 5 | 10 | 0.1 |

探究二:取一部分初产品与稀硫酸反应,为检验实验过程中产生的SO2气体,设计了如图甲、乙和丙的探究装置.
(7)上述装置中最合理的是乙(填“甲”或“乙”或“丙”),写出检验SO2的离子反应方程式5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
4.在恒容的密闭容器中,将一定量的CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g),K=0.1.反应前CO物质的量为10mol,平衡后CO物质的量为8mol.下列说法正确的是( )
| A. | 升高温度,H2S浓度增加,表明正反应是吸热反应 | |
| B. | 反应前H2S物质的量为7mol | |
| C. | 通入CO后,正反应速率逐渐增大,逆反应速率减小 | |
| D. | CO的平衡转化率为80% |
11.2015年7月19日央视《每周质量报告》曝光,近9成EVA儿童地垫含甲酰胺(结构简式 ),EVA
),EVA
材质是乙烯一醋酸乙烯共聚物材质.甲酰胺有生殖毒性,180℃开始部分分解生成CO和NH3,伤害眼睛、皮肤黏膜.下列说法正确的是.
 ),EVA
),EVA材质是乙烯一醋酸乙烯共聚物材质.甲酰胺有生殖毒性,180℃开始部分分解生成CO和NH3,伤害眼睛、皮肤黏膜.下列说法正确的是.
| A. | EVA材质属于高分子化合物材质 | |
| B. | NH3溶于水能导电,所以NH3是电解质 | |
| C. | 甲酰胺的摩尔质量为45 | |
| D. | 甲酰胺分解生成CO和NH3属于氧化还原反应 |
4. 如图锥形瓶中装满了c mol•Lˉ1的Na2SO4溶液,经测定其中含有a mol Na+,则锥形瓶容
如图锥形瓶中装满了c mol•Lˉ1的Na2SO4溶液,经测定其中含有a mol Na+,则锥形瓶容
积为( )
 如图锥形瓶中装满了c mol•Lˉ1的Na2SO4溶液,经测定其中含有a mol Na+,则锥形瓶容
如图锥形瓶中装满了c mol•Lˉ1的Na2SO4溶液,经测定其中含有a mol Na+,则锥形瓶容积为( )
| A. | $\frac{a}{c}$ L | B. | $\frac{a}{2c}$L | C. | ac L | D. | 2ac L |