题目内容
运用元素周期律分析下面推断,其中错误的是( )
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
D
解析试题分析:A.在元素周期表中除了同族元素的性质由相似之处外,还存在对角线相似性。。铍(Be)与铝(Al)处于对角线的位置上,氢氧化铝是两性物质,所以铍(Be)的氧化物的水化物可能具有两性。正确。B.砹(At)是第六周期第ⅦA的元素。从上到下,元素的非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱。因此HAt不稳定;,元素的单质的颜色逐渐加深,砹(At)为有色固体,卤化银都有感光性,既不溶于水也不溶于酸,所以 AgAt感光性很强,但不溶于水也不溶于酸。正确。C.Ba、Sr都是第ⅡA的元素,同种元素形成的化合物性质相似。BaSO4是难溶于水的白色固体,所以硫酸锶(SrSO4)也是难溶于水的白色固体。正确。D.Se、S是同一主族的元素,由于非金属性S>Se。元素的非金属性越强,对应的氢化物的稳定性就越强,所以硒化氢(H2Se)是无色、有毒的气体,不如H2S稳定的物质。错误。
考点:考查元素周期律的应用的知识。

练习册系列答案
相关题目
短周期元素X、Y、Z在元素周期表中的位置如图,关于X、Y、 Z的说法正确的是 ( )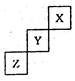
| A.相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B.由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
| C.ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D.Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
下列叙述正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
| C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构 |
| D.IA族与VIIA族元素间形成的化合物,有共价化合物也有离子化合物 |
国外科学家曾将铅(Pb)和氪(Kr)两种元素的原子核对撞,获得了一种质子数为118、
质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为
| A.47 | B.57 | C.61 | D.175 |
元素的性质呈周期性变化的根本原因是( )
| A.元素的原子半径呈周期性变化 |
| B.元素原子量的递增,量变引起质变 |
| C.元素的金属性和非金属性呈周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
下列各基态原子或离子的电子排布式正确的是
| A.O2-1s22s22p4 | B.Ca [Ar]3d2 |
| C.Fe [Ar]3d54s3 | D.Si 1s22s22p63s23p2 |
元素性质呈周期性变化的决定因素是
| A.元素原子核外电子层排布呈周期性变化 |
| B.元素相对原子质量依次递增 |
| C.元素原子半径大小呈周期性变化 |
| D.元素的最高正化合价呈周期性变化 |
下列说法正确的是
| A.短周期元素形成离子后,最外层均达8电子稳定结构 |
| B.多电子原子中,在离核较近的区域运动的电子能量较低 |
| C.非金属元素组成的化合物中只有共价键 |
| D.HF、HCl、HBr、HI的热稳定性和还原性依次增强 |