题目内容
元素的性质呈周期性变化的根本原因是( )
| A.元素的原子半径呈周期性变化 |
| B.元素原子量的递增,量变引起质变 |
| C.元素的金属性和非金属性呈周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
D
解析试题分析:元素的性质呈周期性变化的根本原因是元素原子的核外电子排布呈周期性变化。其它变化都是随着原子核外电子排布的周期性变化而引起的。
考点:考查元素周期律的原因的知识。

练习册系列答案
相关题目
下列排列顺序不正确的是( )
| A.热稳定性:CH4>SiH4>HF | B.原子半径:Na>Mg>O |
| C.酸性:HClO4>H2SO4>H3PO4 | D.非金属性:F>Cl>Br |
关于原子或离子结构的下列说法不正确的是
| A.某原子K层上只有一个电子 |
| B.某原子M层上电子数为L层上电子数的4倍 |
| C.某离子M层上和L层上的电子数均为K层的4倍 |
| D.某离子核电荷数与最外层电子数相等 |
运用元素周期律分析下面推断,其中错误的是( )
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是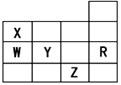
| A.常压下五种元素的单质中Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.Y元素的非金属性比W元素的非金属性强 |
元素R的最高价含氧酸分子式为HnRO2n -2 ,则在气态氢化物中,R元素的化合价为
| A.3n-12 | B.3n-6 | C.3n-4 | D.2n-4 |
下列叙述正确的是
| A.正戊烷与异戊烷互为同系物 |
| B.不同元素的原子形成的分子只含极性共价键 |
C.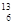 C和 C和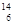 C是中子数不同质子数相同的同种核素 C是中子数不同质子数相同的同种核素 |
| D.短周期第IA与ⅦA族元素既可以形成离子化合物,也可以形成共价化合物 |