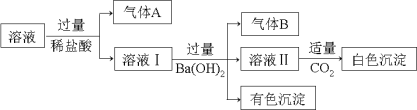
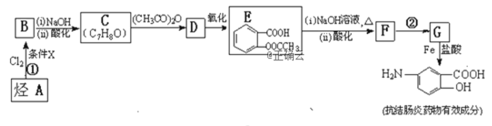
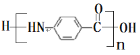
ЬтФПФкШн
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. ОнKspЃЈAgClЃЉ=1.77ЁС10Љ10ЃЌKspЃЈAg2CrO4ЃЉ=2.0ЁС10Љ12ЃЌПЩЭЦжЊAgClШмНтЖШБШAg2CrO4ЕФШмНтЖШДѓ
B. ДІРэЫЎЙИЪБГЃГЃЯШгУЬМЫсФЦШмвКНўХнЃЌдйгУЫсШмНт
C. ЯђЬМЫсБЕГСЕэжаМгШыЯЁСђЫсЃЌГСЕэЗЂЩњзЊЛЏЃЌПЩЭЦжЊСђЫсБЕЕФKspБШЬМЫсБЕЕФДѓ
D. AgClдк10 mL 0.1 mol/LЕФKClШмвКжаШмНтЕФжЪСПБШдк10 mL0.05mol/LЕФAgNO3ШмвКжаЖр
ЁОД№АИЁПB
ЁОНтЮіЁП
AЁЂИљОнШмЖШЛ§ЃЌМЦЫуБЅКЭШмвКжаAgClЁЂAg2CrO4ЮяжЪЕФСПХЈЖШЃЛ
BЁЂЫЎЙИжаЕФСђЫсИЦдкЫсжаШмНтЖШаЁЃЌзЊЛЏГЩЬМЫсИЦКѓЃЌПЩгыбЮЫсЗДгІЩњГЩвзШмЕФТШЛЏИЦЁЃ
CЁЂЯђЬМЫсБЕГСЕэжаМгШыЯЁСђЫсЃЌBaCO3зЊЛЏЮЊBaSO4ЃЛ
DЁЂЩшKspЃЈAgClЃЉ=aЃЌИљОнKspЃЈAgClЃЉ=cЃЈAgЃЋЃЉЁЄcЃЈClЃЃЉМЦЫуKClШмвКжаcЃЈAgЃЋЃЉЃЌAgNO3ШмвКжаcЃЈClЃЃЉЃЌИљОнn=cVМЦЫуnЃЈAgClЃЉЁЃ
AЁЂБЅКЭТШЛЏвјШмвКcЃЈAgClЃЉ=xmolЁЄLЃ1ЃЌдђxЁСx=1.77ЁС10-10ЃЌНтЕУЃКxЁж1.33ЁС10-5ЃЌБЅКЭШмвКжаcЃЈAg2CrO4ЃЉ=ymolЁЄLЃ1ЃЌдђЃЈ2yЃЉ2ЁСy=1.12ЁС10-12ЃЌНтЕУy=![]() =6.54ЁС10-5ЃЌЙЪAg2CrO4ЕФШмНтЖШДѓЃЌЙЪAДэЮѓЃЛ
=6.54ЁС10-5ЃЌЙЪAg2CrO4ЕФШмНтЖШДѓЃЌЙЪAДэЮѓЃЛ
BЁЂЫЎЙИжаЕФСђЫсИЦдкЫсжаШмНтЖШаЁЃЌгУЬМЫсФЦШмвКНўХнКѓзЊЛЏГЩЬМЫсИЦЃЌЬМЫсИЦПЩгыбЮЫсЗДгІЩњГЩвзШмЕФТШЛЏИЦЃЌЙЪBе§ШЗЁЃ
CЁЂЯђЬМЫсБЕГСЕэжаМгШыЯЁСђЫсЃЌBaCO3зЊЛЏЮЊBaSO4ЃЌЬМЫсБЕЕФШмЖШЛ§Ksp=c(Ba2ЃЋ)c(CO32Ѓ)ЃЌСђЫсБЕЕФШмЖШЛ§Ksp=c(Ba2ЃЋ)c(SO42Ѓ)ЃЌСђЫсБЕЕФKspБШЬМЫсБЕЕФаЁЃЌЙЪCДэЮѓЃЛ
DЁЂЩшKspЃЈAgClЃЉ=aЃЌдђ0.1molЁЄL-1ЕФKClШмвКжаcЃЈAgЃЋЃЉ=![]() molЁЄLЃ1=10amolЁЄLЃ1ЃЌЙЪ10mLШмвКПЩвдШмНтЕФТШЛЏвјnЃЈAgClЃЉ=0.01LЁС10amolЁЄLЃ1=0.1amolЃЌ0.05molЁЄL-1ЕФAgNO3ШмвКжаcЃЈClЃЃЉ=
molЁЄLЃ1=10amolЁЄLЃ1ЃЌЙЪ10mLШмвКПЩвдШмНтЕФТШЛЏвјnЃЈAgClЃЉ=0.01LЁС10amolЁЄLЃ1=0.1amolЃЌ0.05molЁЄL-1ЕФAgNO3ШмвКжаcЃЈClЃЃЉ=![]() molЁЄLЃ1=20amolЁЄLЃ1ЃЌЙЪ10mLЯѕЫсвјШмвКПЩвдШмНтТШЛЏвјnЃЈAgClЃЉ=0.01LЁС20amolЁЄLЃ1=0.2amolЃЌЧАепШмНтЕФСПЩйЃЌЙЪDДэЮѓЃЛ
molЁЄLЃ1=20amolЁЄLЃ1ЃЌЙЪ10mLЯѕЫсвјШмвКПЩвдШмНтТШЛЏвјnЃЈAgClЃЉ=0.01LЁС20amolЁЄLЃ1=0.2amolЃЌЧАепШмНтЕФСПЩйЃЌЙЪDДэЮѓЃЛ
ЙЪбЁЃКBЁЃ

ЁОЬтФПЁПЛЏбЇгыЩчЛсЁЂЩњЛюУмЧаЯрЙиЃЌЖдЯТСаЯжЯѓЛђЪТЪЕЕФНтЪЭе§ШЗЕФЪЧЃЈ ЃЉ
ЯжЯѓЛђЪТЪЕ | НтЪЭ | |
A | гУШШЕФДПМюШмвКШЅгЭЮл | Na2CO3ПЩжБНггыгЭЮлЗДгІ |
B | ЦЏАзЗлдкПеЦјжаОУжУБфжЪ | ЦЏАзЗлжаЕФCaCl2гыПеЦјжаЕФCO2ЗДгІЩњГЩCaCO3 |
C | ЪЉЗЪЪБЃЌВнФОЛвЃЈжївЊГЩЗжK2CO3ЃЉВЛФмгыNH4ClЛьКЯЪЙгУ | K2CO3гыNH4ClдкГБЪЊЕФЭСШРжаЛсЗДгІЩњГЩАБЦјЃЌНЕЕЭЗЪаЇ |
D | FeCl3ШмвКПЩгУгкЭжЪгЁЫЂЯпТЗАхжЦзї | CuФмДгFeCl3ШмвКжаАбЬњЛЙдЮЊгЮРыЬЌ |
A.AB.BC.CD.D
ЁОЬтФПЁПЯТБэЫљСаЕФЪЧЮхжжЖЬжмЦкдЊЫиЕФдзгАыОЖМАжївЊЛЏКЯМл(вбжЊюыЕФдзгАыОЖЮЊ0.089nm)ЁЃ
дЊЫиДњКХ | A | B | C | D | E |
дзгАыОЖ/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
жївЊЛЏКЯМл | ЃЋ2 | ЃЋ3 | ЃЋ6ЁЂЃ2 | Ѓ1 | Ѓ2 |
(1)БШНЯAЁЂBЁЂEШ§жждЊЫиЕФМђЕЅРызгЕФРызгАыОЖДѓаЁ___(гУЖдгІдЊЫиРызгЗћКХБэЪО)ЁЃ
(2)AдЊЫиМђЕЅРызгЕФНсЙЙЪОвтЭМЮЊ__ЃЌBдЊЫиЮЛгкжмЦкБэжаЕк__жмЦк__зхЁЃ
(3)BЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮягыCЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЗДгІЕФРызгЗНГЬЪНЮЊ__ЁЃ
(4)ЩЯЪіЮхжждЊЫиЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяжаЫсадзюЧПЕФЪЧ__(ЬюЛЏбЇЪН)ЁЃ
(5)CЁЂEаЮГЩЕФЛЏКЯЮяЮЊ__(ЬюЛЏбЇЪН)ЁЃ
(6)гУЕчзгЪНБэЪОAКЭDаЮГЩЛЏКЯЮяЕФЙ§ГЬ___ЁЃ