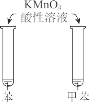
题目内容
【题目】下列溶液中浓度关系正确的是
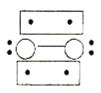
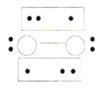
A.小苏打溶液中:c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
B.CH3COONa溶液中:c(CH3COO-) > c(Na+) > c(OH-) > c(H+)
C.0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
D.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
【答案】D
【解析】
A.小苏打溶液中存在的电荷守恒式为c(Na+)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),故A错误;
)+c(OH-),故A错误;
B.CH3COONa溶液显碱性,则c(OH-) > c(H+),溶液中存在的电荷守恒式为c(CH3COO-) +c(OH-) = c(Na+) + c(H+),则c(Na+) > c(CH3COO-),即溶液中:c(Na+) >c(CH3COO-) > c(OH-) > c(H+),故B错误;
C.0.1 mol/L的NaHA溶液,其pH=4,说明HA-的电离程度大于HA-的水解程度,则c(A2-) > c(H2A),即c(HA-)>c(H+) >c(A2-)>c(H2A),故C错误;
D.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合后,溶液中存在的电荷守恒式为c(CH3COO-)+c(OH-)=c(H+)+c(Na+),物料守恒式为2c(Na+)= c(CH3COO-)+c(CH3COOH),则c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),故D正确;
故答案为D。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目