题目内容
【题目】我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。Cu和Zn在元素周期表中位于_____区,请写出基态Cu原子的价电子排布式_______________。第一电离能Il(Zn)_______Il(Cu)(填“大于”或“小于”),原因是________。
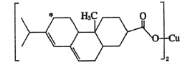
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式,请分析1个松脂酸铜中π键的个数是______,加“*”碳原子的杂化方式为________。
(3)硫酸铜溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
①在[Cu(NH3)4]2+中Cu2+、NH3之间形成的化学键为____,提供孤电子对的成键原子是______。
②![]() 立体构型是_____________。
立体构型是_____________。
③NH3的沸点 _________(填“高于”或“低于”)PH3;
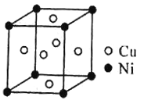
(4)一种铜镍合金(俗称白铜)的晶胞如下图所示,铜、镍原子个数比为__________。
【答案】ds 3d104s1 大于 Zn核外电子排布为全满结构,难失去电子 6 sp3 配位键 N(或氮原子) 正四面体 高于 3:1
【解析】
(1)Cu原子核外有29个电子,其3d、4s电子为其外围电子,所以Cu的价层电子排布式3d104s1;铜和锌分别位于第四周期第ⅠB、ⅡB族,属于ds区。轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,Zn原子轨道中电子处于全满状态,Cu失去一个电子内层电子达到全充满稳定状态,所以Cu较Zn易失电子,则第一电离能Cu<Zn。
(2)1个松脂酸铜中含有6个双键,则含有6个π键,加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4,采取sp3杂化;
(3)①N原子提供孤电子对、Cu原子提供空轨道,二者形成配位键,提供孤电子对的成键原子是N。
②硫酸根离子中S原子价层电子对个数=4+![]() =4且不含孤电子对,根据价层电子对互斥理论判断微粒空间构型为正四面体形;
=4且不含孤电子对,根据价层电子对互斥理论判断微粒空间构型为正四面体形;
③氨气中能形成分子间氢键、磷化氢分子之间不能形成氢键,所以氨气熔沸点较高;
(4)根据晶胞结构,镍位于顶点,铜位于面心,则晶胞中镍原子的数量为![]() ,铜原子的数量为
,铜原子的数量为![]() ,故铜、镍原子个数比为3:1。
,故铜、镍原子个数比为3:1。

【题目】下表中相关物质的信息都正确的一项是( )
选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
A |
|
| 不稳定,易分解 | 医用消毒剂 |
B |
| 离子键、共价键 | 强氧化性 | 消毒液 |
C |
| 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
D |
| 离子键 | 受热易分解 | 泡沫灭火器 |
A.AB.BC.CD.D