题目内容
19.某苛性钾样品中含有不与酸反应的杂质,为了测定苛性钾的纯度,取样品0.56g溶于水制成1L溶液.取此溶液25.00mL,用0.005mol/LH2SO4标准液滴定,用去24mL标准液.则苛性钾的纯度为( )| A. | 96% | B. | 48% | C. | 9.6% | D. | 56% |
分析 发生反应:2KOH+H2SO4=K2SO4+H2O,根据方程式计算25mL溶液中KOH的物质的量,再计算1L溶液中KOH的物质的量,根据m=nM计算0.56g样品中KOH的质量,进而计算样品中KOH的纯度.
解答 解:24mL硫酸溶液中n(H2SO4)=24×10-3L×0.005mol/L=1.2×10-4mol,
由2KOH+H2SO4=K2SO4+H2O,可知25mL溶液中n(KOH)=2n(H2SO4)=2×1.2×10-4mol=2.4×10-4mol,
则1L溶液中KOH物质的量为2.4×10-4mol×$\frac{1000mL}{25mL}$=9.6×10-3mol,
故样品中KOH的纯度为$\frac{9.6×1{0}^{-3}mol×56g/mol}{0.56g}$×100%=96%,
故选:A.
点评 本题考查中和滴定有关计算,比较基础,注意对基础知识的理解掌.

练习册系列答案
相关题目
9.对于原子半径的理解,不正确的是( )
| A. | 同周期元素(除了稀有气体元素外),从左到右,原子半径依次减小 | |
| B. | 对于第三周期元素,从钠到氯,原子半径依次减小 | |
| C. | 各元素的原子半径总比其离子半径大 | |
| D. | 阴离子的半径大于其原子半径,阳离子的半径小于其原子半径 |
14.在足量的稀氯化亚铁溶液中加入1~2滴液溴,振荡后溶液变为黄色.为了探究溶液变为黄色的原因,甲、乙两位同学提出了不同的观点:
(1)甲同学认为是:Br2溶于水变成黄色溶液;乙认为是:Fe2+被氧化成Fe3+使溶液变成黄色.
(2)现提供试剂:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液
并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
(3)若选用淀粉碘化钾溶液判断哪位同学的推断正确,是否可行?(填“可行”或不可行)不可行;,理由是因为Br2和Fe3+都能把I-氧化成I2
(4)向稀溴化亚铁溶液中通入过量氯气的离子反应方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-.
(1)甲同学认为是:Br2溶于水变成黄色溶液;乙认为是:Fe2+被氧化成Fe3+使溶液变成黄色.
(2)现提供试剂:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液
并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | 四氯化碳 | |
| 第二种方法 | 硫氰化钾溶液 |
(4)向稀溴化亚铁溶液中通入过量氯气的离子反应方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-.
11.实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时的现象:最后一滴NaOH溶液滴下,溶液由无色到粉红(或浅红),且半分钟内不变色.
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.101 0mol/L,则该样品中氮的质量分数为_18.85%.
步骤Ⅰ:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时的现象:最后一滴NaOH溶液滴下,溶液由无色到粉红(或浅红),且半分钟内不变色.
(2)滴定结果如下表所示:
| 滴定 次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
9.x、y为两元素的原子,x的阴离子与y的阳离子的电子层结构相同,由此可知( )
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x的金属性大于y的金属性 | |
| D. | x的电负性大于y的电负性 |
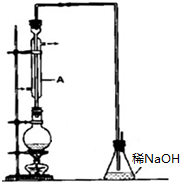 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下: