题目内容
【题目】CO2是地球上取之不尽用之不竭的碳源,捕集、利用 CO2 始终是科学研究的热点。
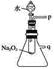
⑴新的研究表明,可以将 CO2 转化为炭黑回收利用,反应原理如图所示。
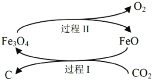
①整个过程中 FeO 的作用是_____________;
②写出 CO2 转化为炭黑的总反应化学方程式_____________。
⑵由CO2 合成甲醇是CO2资源化利用的重要方法。
研究表明在催化剂作用下CO2 和H2可发生反应:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH
CH3OH(g) + H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_______。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比n(CO2 )/ n(H2)
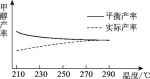
②研究温度对于甲醇产率的影响。在210 ℃~290 ℃,保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如下图所示。ΔH____0(填“>”或“<”),其依据是_______。
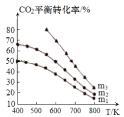
⑶工业用二氧化碳加氢可合成乙醇:![]() 保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比
保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比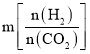 的关系如图所示。
的关系如图所示。
①该反应平衡常数的表达式为_________________。
②投料比m1、m2、m3由大到小的顺序为 _________________。
【答案】催化剂 CO2  C+O2 b < 温度升高,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应
C+O2 b < 温度升高,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应 ![]() m3 > m2> m1
m3 > m2> m1
【解析】
⑴①FeO参与了化学反应但FeO的量没有变化;②根据图像分析CO2反应。
⑵①a.使用催化剂,平衡不移动,转化率不变;b.该反应是体积减小的反应,加压,平衡正向移动,CO2的平衡转化率增大;c.增大初始投料比n(CO2)/n(H2),可以理解为n(H2)不变,n(CO2)增大,平衡正向移动,但CO2的平衡转化率减小;②升高温度,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应,即ΔH<0;故答案为:<;温度升高,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应。
⑶①根据反应方程式书写平衡常数表达式;②投料比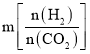 ,理解为n(CO2)不变,n(H2)增大,平衡正向移动,CO2的平衡转化率增大。
,理解为n(CO2)不变,n(H2)增大,平衡正向移动,CO2的平衡转化率增大。
⑴①FeO在反应过程中参与了化学反应,但FeO的量没有变化,因此FeO的作用是催化剂;故答案为:催化剂。
②FeO和CO2反应生成C和Fe3O4,Fe3O4反应生成FeO和O2,因此CO2转化为炭黑的总反应化学方程式CO2 C+O2;故答案为:CO2
C+O2;故答案为:CO2 C+O2。
C+O2。
⑵①a.使用催化剂,平衡不移动,转化率不变,故a不符合题意;b.该反应是体积减小的反应,加压,平衡正向移动,CO2的平衡转化率增大,故b符合题意;c.增大初始投料比n(CO2)/n(H2),可以理解为n(H2)不变,n(CO2)增大,平衡正向移动,但CO2的平衡转化率减小,故c不符合题意;综上所述,答案为b。
②升高温度,温度升高,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应,即ΔH<0;故答案为:<;升高温度,温度升高,甲醇的平衡产率降低,平衡逆向移动,则逆向是吸热反应,正向放热反应。
⑶①该反应平衡常数的表达式为![]() ;故答案为:
;故答案为:![]() 。
。
②投料比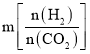 ,理解为n(CO2)不变,n(H2)增大,平衡正向移动,CO2的平衡转化率增大,因此投料比m1、m2、m3由大到小的顺序为m3 > m2> m1;故答案为:m3 > m2> m1。
,理解为n(CO2)不变,n(H2)增大,平衡正向移动,CO2的平衡转化率增大,因此投料比m1、m2、m3由大到小的顺序为m3 > m2> m1;故答案为:m3 > m2> m1。

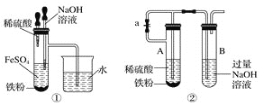
【题目】某小组研究NH4Cl与CuO的反应,进行如下实验(部分装置略):
实验 | Ⅰ | Ⅱ |
装置 |
|
|
现象 | 加热试管,产生白烟,试管口有白色固体;试管中有水生成,继续加热,黑色固体变蓝,最终部分变为黄色 | 将细玻璃管口加热至红热,迅速垂直插入 NH4Cl晶体中,一段时间后,取出玻璃管,管口处有亮红色固体 |
经检测,实验Ⅰ中的黄色固体含有CuCl和CuCl2,实验Ⅱ中的亮红色固体为Cu。
(1)实验Ⅰ中试管口的白色固体是______。
(2)实验Ⅰ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:
![]()
①(NH4)2CuCl4固体受热分解的化学方程式是______。
②对于物质X,做出如下假设:
ⅰ.X是NH4Cl。
反应方程式为:________________________________(补充完整)
ⅱ.X是______,理由是______。
(3)实验Ⅰ和实验Ⅱ的现象不同,可能的原因是______(列出2点)。
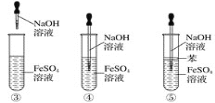
(4)NH4Cl溶液与CuO反应。
实验Ⅲ 向CuO粉末中加入0.1 mol·L1 NH4Cl溶液,浸泡一段时间后,固体部分溶解,表面无颜色变化,溶液变为蓝色。
资料:ⅰ.相关微粒在水溶液中的颜色:Cu2+蓝色,Cu(NH3)2+和Cu(NH3)42+深蓝色
ⅱ.Cu(NH3)2+![]() Cu2++NH3 Cu(NH3)42+
Cu2++NH3 Cu(NH3)42+![]() Cu2++4NH3
Cu2++4NH3
①设计实验证明实验Ⅲ得到的蓝色溶液中存在Cu(NH3)2+或Cu(NH3)42+。
实验方案是______。
②实验Ⅲ中未观察到NH4Cl溶液与CuO发生氧化还原反应的产物,可能的原因是______(列出1点即可)。
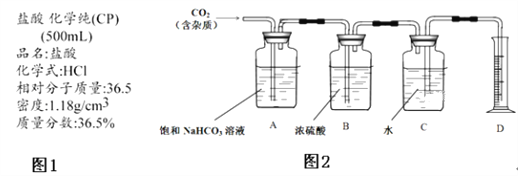
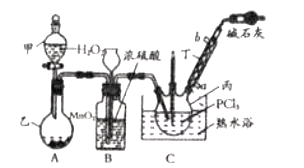
【题目】利用![]() 和
和![]() 为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知![]() 和三氯氧磷的性质如下表:
和三氯氧磷的性质如下表:
熔点 | 沸点 | 其他物理或化学性质 | |
|
|
|
|
|
|
|
(1)仪器乙的名称是__________。
(2)实验过程中仪器丁的进水口为__________(选填“![]() ”或“
”或“![]() ”)口。
”)口。
(3)装置B的作用是__________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(4)整个装置必须干燥,若未干燥,写出所有副反应的化学方程式______________________________。
(5)制备三氯氧磷所用PCl3测定纯度的方法如下:迅速称取![]() 产品,水解完全后配成
产品,水解完全后配成![]() 溶液,取出
溶液,取出![]() 入过量的
入过量的![]() 碘溶液,充分反应后再用
碘溶液,充分反应后再用![]() 溶液滴定过量的碘,终点时消耗
溶液滴定过量的碘,终点时消耗![]() 溶液。
溶液。
已知:![]() ;
;![]() ;假设测定过程中没有其他反应。根据上述数据,该产品中
;假设测定过程中没有其他反应。根据上述数据,该产品中![]() (相对分子质量为137.5)的质量分数的计算式为__________%。(用含
(相对分子质量为137.5)的质量分数的计算式为__________%。(用含![]() 的代数式表示)
的代数式表示)