题目内容
4.用NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 常温常压下,1mol Mg与足量盐酸反应失去电子数为2NA | |
| B. | 标准状况下,11.2L H2O所含的分子数为0.5NA | |
| C. | 0.1molCH4所含的电子数为NA | |
| D. | 通常状况下,NA 个CO2分子占有的体积为22.4L |
分析 A、根据反应后镁元素变为+2价来分析;
B、标况下水为液态;
C、甲烷为10电子微粒;
D、通常状况下气体摩尔体积大于22.4L/mol.
解答 解:A、由于反应后镁元素变为+2价,故1mol镁失去2mol电子即2NA个,故A正确;
B、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和分子数,故B错误;
C、甲烷为10电子微粒,故0.1mol甲烷中含1mol电子即NA个,故C正确;
D、通常状况下气体摩尔体积大于22.4L/mol,故NA个二氧化碳分子即1mol二氧化碳分子的体积大于22.4L,故D错误.
故选AC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
14.甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如图1所示.则平衡状态由A变到B时,平衡常数KA=KB(填“>”、“<”或“=”).据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示),反应③为放热反应(填“吸热”或“放热”).
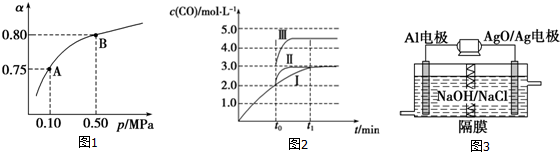
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
(4)甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼雷电池,其原理如图3所示.则该电池的负极反应式是Al-3e-+4OH-=AlO2-+2H2O.
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将a mol•L-1的醋酸与b mol•L-1 Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}×1{0}^{-7}$L/mol.
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如图1所示.则平衡状态由A变到B时,平衡常数KA=KB(填“>”、“<”或“=”).据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示),反应③为放热反应(填“吸热”或“放热”).

(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
(4)甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼雷电池,其原理如图3所示.则该电池的负极反应式是Al-3e-+4OH-=AlO2-+2H2O.
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将a mol•L-1的醋酸与b mol•L-1 Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}×1{0}^{-7}$L/mol.
15.恒温恒压下,对于反应X2(g)+Y2(g)?2XY(g)达到平衡状态的标志是( )
| A. | V正(X2)═2V逆(XY) | |
| B. | 单位时间内生成2n mol XY的同时,生n mol的Y2 | |
| C. | 容器内气体密度不随时间而变化 | |
| D. | X2、Y、XY的浓度之比为2:2:1 |
19.下列叙述中,正确的是( )
| A. | 物质的量是国际科学界建议采用的一种物理量 | |
| B. | 摩尔质量就等于物质的相对分子质量 | |
| C. | 1gH2和1 mol H2O的物质的量相等 | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
9.对于溶液的pH,下列说法正确的是( )
| A. | pH=0的溶液呈中性 | |
| B. | 溶液pH相差3,则c(H+)相差30倍 | |
| C. | pH=5的HCl加水稀释1000倍后,溶液pH=8 | |
| D. | pH=5的CH3COOH溶液酸性比pH=6的HCl溶液的酸性强 |
 A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式:
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式: