题目内容
14.新型纳米材料氧缺位铁酸锌(ZnFe2Ox,3<x<4,Zn的化合价为+2价,下同),工业上可由铁酸锌(ZnFe2O4)经过高温反应得到.(1)ZnFe2O4中Fe元素的化合价为+3.
(2)将纳米材料氧缺位铁酸盐分散在蒸馏水中,形成的分散系和NaCl溶液的本质区别是分散质微粒直径大小不同.
(3)ZnFe2O4经过高温反应得到ZnFe2Ox的反应属于氧化还原(填“氧化还原”或“非氧化还原”)反应.(4)酸性条件下,Fe2O42-容易转化为Fe2+,该反应体系中的粒子有:Fe2O42-、Fe2+、H+、H2O、Cu2O、Cu2+,该反应的离子方程式为Fe2O42-+Cu2O+10H+═2Fe2++2Cu2++5H2O,该反应中的氧化产物是Cu2+.
分析 (1)依据化合价代数和为0计算判断;
(2)三大分散系的本质区别是分散质微粒直径大小不同;
(3)依据铁酸盐MFe2O4经过高温反应得到MFe2Ox,3<x<4,M=Mn、Zn、Ni,且均为+2价,说明铁元素的化合价发生变化分析判断;依据氧化还原反应的特征是元素化合价有升高的,有降低的,化合价升高元素所在的反应物是还原剂,对应产物是氧化产物.
解答 解:(1)依据化合物MFe2O4中元素化合价代数和为0,即M的化合价为+2价,氧元素为-2价,铁元素的化合价为x,则+2+2x+(-2×4)=0,x=+3,故答案为:+3;
(2)将纳米材料氧缺位铁酸盐分散在蒸馏水中,形成的分散系属于胶体分散系,胶体和NaCl溶液的本质区别是分散质微粒直径大小不同,故答案为:分散质微粒直径大小不同;
(3)铁酸盐MFe2O4经过高温反应得到MFe2Ox的,根据题干中的信息,3<x<4,M=Mn、Zn、Ni,且均为+2价,可知变化过程中铁元素化合价发生了变化,是氧化还原反应;
在酸性条件下,Fe2O42-容易转化为Fe2+,铁元素的化合价从+3价变化为+2价,化合价降低做氧化剂,反应体系中共存在下列6种粒子:Fe2O42-、Fe2+、H+、H2O、Cu2O、Cu2+,能做还原剂的物质中元素化合价升高,才能符合氧化还原反应的特征元素化合价有升有降,所以Cu2O变化为Cu2+,符合化合价升高的变化,故氧化剂为Fe2O42-,Fe元素的化合价要降低为亚铁离子,根据电子守恒和元素守恒,该反应的离子方程式为Fe2O42-+Cu2O+10H+═2Fe2++2Cu2++5H2O,化合价升高Cu元素所在的反应物Cu2O是还原剂,对应产物Cu2+是氧化产物,
故答案为:5H2O、Cu2+.
点评 本题考查了纳米材料的结构特点,分散系的本质特征,化合物中元素化合价的计算,氧化还原反应特征的应用,关键是信息的综合应用.

| A. | 常温常压下,1mol Mg与足量盐酸反应失去电子数为2NA | |
| B. | 标准状况下,11.2L H2O所含的分子数为0.5NA | |
| C. | 0.1molCH4所含的电子数为NA | |
| D. | 通常状况下,NA 个CO2分子占有的体积为22.4L |
| A. | 硫粉和铁粉的混合物 | B. | 氯化氢和溴化氢的混合物 | ||
| C. | 溴和CCl4的混合物 | D. | 碘与食盐的混合物 |
| A. | 碘水、淀粉溶液 | B. | 溴水、汽油 | ||
| C. | 氯水、淀粉溶液 | D. | 硝酸银溶液、稀硝酸 |
| A. | Ba(NO3)2溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | CH3COOH溶液 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |


 ;
; +O2$→_{△}^{Cu}$OHCCHO+2H2O;
+O2$→_{△}^{Cu}$OHCCHO+2H2O;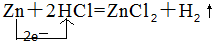 ;
;