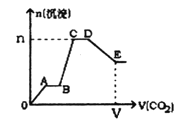
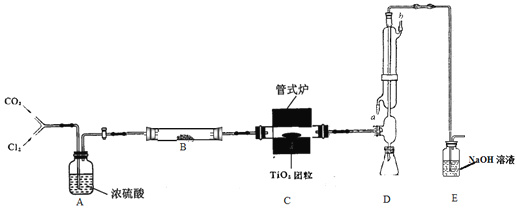
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L正戊烷中含有的碳原子数为0.5 NA
B. 1L0.1mol·L-1NaHCO3溶液中所含HCO3-的数目为0.1NA
C. 一定条件下,0.1mol CO与0.1mol H2O(g)充分反应,生成H2的分子数为0.1NA
D. 在反应:3FeS2+12C+8O2=Fe3O4+12CO+6S中,每生成0.6molS,转移的电子数为3.2NA
【答案】D
【解析】A项,正戊烷在标准状况下不呈气态,不能用22.4L/mol计算正戊烷分子物质的量;B项,HCO3-在溶液中既存在电离平衡又存在水解平衡;C项,CO与H2O(g)生成CO2和H2的反应为可逆反应;D项,反应中S元素的化合价由-1价升至0价,C元素的化合价由0价升至+2价,Fe元素的化合价部分由+2价升至+3价(Fe3O4可写成FeO·Fe2O3),O元素的化合价全由0价降至-2价,生成6molS,转移32mol电子。
A项,正戊烷在标准状况下不呈气态,不能用22.4L/mol计算正戊烷分子物质的量,A项错误;B项,n(NaHCO3)=0.1mol/L![]() 1L=0.1mol,HCO3-在溶液中既存在电离平衡又存在水解平衡,溶液中所含HCO3-物质的量小于0.1mol,B项错误;C项,CO与H2O(g)生成CO2和H2的反应为可逆反应,反应的化学方程式为CO+H2O(g)
1L=0.1mol,HCO3-在溶液中既存在电离平衡又存在水解平衡,溶液中所含HCO3-物质的量小于0.1mol,B项错误;C项,CO与H2O(g)生成CO2和H2的反应为可逆反应,反应的化学方程式为CO+H2O(g)![]() CO2+H2,0.1molCO与0.1molH2O(g)充分反应生成的H2物质的量小于0.1mol,C项错误;D项,反应中S元素的化合价由-1价升至0价,C元素的化合价由0价升至+2价,Fe元素的化合价部分由+2价升至+3价(Fe3O4可写成FeO·Fe2O3),O元素的化合价全由0价降至-2价,生成6molS,转移32mol电子,每生成0.6molS,转移电子物质的量为3.2mol,D项正确;答案选D。
CO2+H2,0.1molCO与0.1molH2O(g)充分反应生成的H2物质的量小于0.1mol,C项错误;D项,反应中S元素的化合价由-1价升至0价,C元素的化合价由0价升至+2价,Fe元素的化合价部分由+2价升至+3价(Fe3O4可写成FeO·Fe2O3),O元素的化合价全由0价降至-2价,生成6molS,转移32mol电子,每生成0.6molS,转移电子物质的量为3.2mol,D项正确;答案选D。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
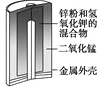
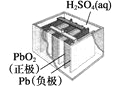
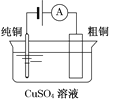
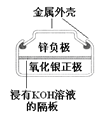
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
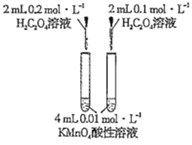
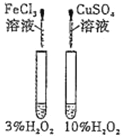
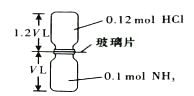
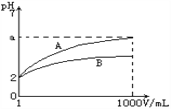
【题目】下列实验方案中不能达到相应实验目的的是
选项 | A | B | C | D |
方案 |
|
|
|
|
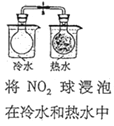
目的 | 探究浓度对化学反应速率的影响 | 探究催化剂对H2O2分解速率的影响 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
A. A B. B C. C D. D