题目内容
【题目】碳及其化合物有广泛的用途.
(1)反应C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJmol﹣1 , 达到平衡后,体积不变时,以下有利于提高H2产率的措施是 .
A.增加碳的用量
B.升高温度
C.用CO吸收剂除去CO
D.加入催化剂
(2)已知,C(s)+CO2(g)2CO(g)△H=+172.5kJmol﹣1则反应 CO(g)+H2O(g)CO2(g)+H2(g)△H= .
(3)CO与H2一定条件下反应生成甲醇(CH3OH),可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为 .
(4)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下数据:
t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
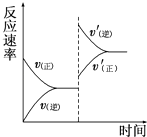
①其它条件不变,降低温度,达到新平衡前 v(逆)v(正)(填“>”、“<”或“=”).
②该温度下,此反应的平衡常数K=;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数
(填“增大”、“减小”或“不变”).
【答案】
(1)BC
(2)﹣41.2kJ?mol﹣1
(3)CH3OH(g)+H2O﹣6e﹣=CO2+6H+
(4)<;![]() ;不变
;不变
【解析】解:(1)A.增加碳的用量,浓度不变,平衡不移动,故错误; B.升高温度,平衡正向移动,H2产率增大,故正确;
C.用CO吸收剂除去CO,平衡正向移动,H2产率增大,故正确;
D.加入催化剂,平衡不移动,故错误;
故选:BC;(2)已知:①C(s)+H2O(g)CO(g)+H2(g),△H=+131.3kJmol﹣1 ,
②C(s)+CO2(g)2CO(g),△H=+172.5kJmol﹣1
根据盖斯定律,①﹣②得:CO(g)+H2O(g)CO2(g)+H2(g),△H=131.3kJmol﹣1﹣172.5kJmol﹣1=﹣41.2kJmol﹣1 ,
所以答案是:﹣41.2kJmol﹣1;(3)甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,负极电极反应为:CH3OH6e﹣+8OH﹣═CO32﹣+6H2O
所以答案是:CH3OH(g)+H2O﹣6e﹣=CO2+6H+;(4)①正反应放热,降温时平衡正向移动,v(正)>v(逆),所以答案是:<;
②CO和H2O反应了0.06mol,则CO2和H2生成了0.06mol,平衡时各物质的浓度为:反应物CO和H2O为0.05mol/L,生成物CO2和H2为0.03mol/L,平衡常数表达式为K= ![]() =
= ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() ;
;
③反应前后气体体积不变,与原平衡等比例加入反应物,平衡与原平衡等效,所以,平衡时各物质的浓度与原判断相同,所以答案是:不变.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.