��Ŀ����
����Ŀ����5.10gþ���Ͻ����120mL4.0molL��1�������У����Ͻ���ȫ�ܽ�õ���ҺX������˵��һ����ȷ���ǣ� ��
A.�Ͻ���ȫ�ܽ�������H2�����ʵ���Ϊ0.24mol
B.�Ͻ��е�þ���������ʵ���֮��С��1
C.������ҺX�м���270mL2.0molL��1NaOH��Һ����ַ�Ӧ�����ó���ΪMg��OH��2
D.������ҺX�м��������İ�ˮ����ַ�Ӧ�����ó����������ˡ�ϴ�Ӻ������գ������������������8.50g
���𰸡�D
���������⣺A������ȫ����þ�����ʵ���Ϊ�� ![]() =0.21mol������������Ϊ0.42mol����������Ϊ0.21mol������ȫ�������������ʵ���Ϊ��
=0.21mol������������Ϊ0.42mol����������Ϊ0.21mol������ȫ�������������ʵ���Ϊ�� ![]() =0.3mol����������Ϊ0.9mol���������������ʵ���Ϊ0.24mol��������������ʵ���Ϊ0.48mol����A���� B����5.10gþ���Ͻ����120mL4.0molL��������Һ�У����Ͻ���ȫ�ܽ��˵��������Ͻ�ǡ����ȫ��Ӧ���������������Ͻ���þ�������ʵ����ֱ�Ϊ��xmol��ymol����24x+27y=5.1��2x+3y=0.48����֮�ã�x��ֵԼΪ0.1mol������������˵��þ�ĺ���������Ͻ��е�þ���������ʵ���֮�ȴ���1����B����
=0.3mol����������Ϊ0.9mol���������������ʵ���Ϊ0.24mol��������������ʵ���Ϊ0.48mol����A���� B����5.10gþ���Ͻ����120mL4.0molL��������Һ�У����Ͻ���ȫ�ܽ��˵��������Ͻ�ǡ����ȫ��Ӧ���������������Ͻ���þ�������ʵ����ֱ�Ϊ��xmol��ymol����24x+27y=5.1��2x+3y=0.48����֮�ã�x��ֵԼΪ0.1mol������������˵��þ�ĺ���������Ͻ��е�þ���������ʵ���֮�ȴ���1����B����
C������������ƹ������ó���Ϊ������þ������������Ʋ�������л�����������������C����
D������ȫ����þ�����ʵ���Ϊ�� ![]() =0.21mol������þ������Ϊ��0.21��40=8.4g�����ȫ��������������������Ϊ��0.15��102=15.3g��8.50g������֮�䣬��D��ȷ��
=0.21mol������þ������Ϊ��0.21��40=8.4g�����ȫ��������������������Ϊ��0.15��102=15.3g��8.50g������֮�䣬��D��ȷ��
��ѡD��
A������ȫ����þ�����ʵ���Ϊ�� ![]() =0.21mol������������Ϊ0.42mol������ȫ�������������ʵ���Ϊ��
=0.21mol������������Ϊ0.42mol������ȫ�������������ʵ���Ϊ�� ![]() =0.3mol����������Ϊ0.9mol���������������ʵ���Ϊ0.24mol��
=0.3mol����������Ϊ0.9mol���������������ʵ���Ϊ0.24mol��
B����5.10gþ���Ͻ����120mL4.0molL��������Һ�У����Ͻ���ȫ�ܽ��˵��������Ͻ�ǡ����ȫ��Ӧ�������������
C������������ƹ������ó���Ϊ������þ������������Ʋ�������л���������������
D��������ҺX�м��������İ�ˮ����Ϊ�������������ڰ�ˮ���������ó���Ϊ������þ������������ȼ�յ�����þ�����������ɴ˷�����𣮡�

 �����Ծ�ϵ�д�
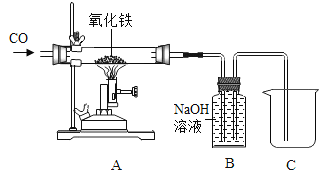
�����Ծ�ϵ�д� �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д�����Ŀ��̼���仯�����й㷺����;��
��1����ӦC��s��+H2O��g��CO��g��+H2��g����H=+131.3kJmol��1 �� �ﵽƽ����������ʱ���������������H2���ʵĴ�ʩ�� ��
A.����̼������
B.�����¶�
C.��CO���ռ���ȥCO
D.�������
��2����֪��C��s��+CO2��g��2CO��g����H=+172.5kJmol��1��Ӧ CO��g��+H2O��g��CO2��g��+H2��g����H= ��
��3��CO��H2һ�������·�Ӧ���ɼ״���CH3OH���������ü״����һ��ȼ�ϵ�أ���KOH��Һ���������Һ�����ʯī���缫���õ�ظ�����ӦʽΪ ��
��4����һ���¶��£���CO��g����H2O��g����0.16mol�ֱ�ͨ�뵽���Ϊ2.0L�ĺ����ܱ������У��������·�Ӧ��CO��g��+H2O��g��CO2��g��+H2��g�����õ��������ݣ�
t/min | 2 | 4 | 7 | 9 |
n��H2O��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
�������������䣬�����¶ȣ��ﵽ��ƽ��ǰ v���棩v�����������������������=������
�ڸ��¶��£��˷�Ӧ��ƽ�ⳣ��K=��
�������������䣬�ٳ���0.1mol CO��0.1mol H2O��g����ƽ��ʱCO���������
�����������С�����䡱����