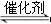题目内容
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
A.CuS<Cu(OH)2<CuCO3 B.CuCO3<Cu(OH)2<CuS
C.CuS<CuCO3<Cu(OH)2 D.Cu(OH)2<CuCO3<CuS
A
【解析】
试题分析:沉淀反应中,生成物的溶解度越小,沉淀反应越容易发生,
(1)主要发生Cu2++CO32─+H2O=Cu(OH)2↓+CO2↑,次要发生Cu2++CO32─=CuCO3↓,可说明Cu(OH)2溶解度小于CuCO3的溶解度,
(2)主要:Cu2++S2─=CuS↓,次要:Cu2++S2─+2H2O=Cu(OH)2↓+H2S↑,可说明CuS的溶解度小于Cu(OH)2的溶解度,
则溶解度CuS<Cu(OH)2<CuCO3, 故选A.
考点:难溶电解质的溶解平衡

某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数