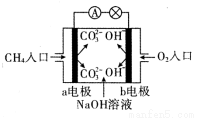
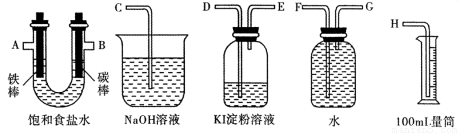
题目内容
下列表述不正确的是
A.对于一个确定的反应来说,平衡常数的数值越大,反应限度越大
B.铝热反应会放出大量的热,因此常温下就能顺利发生
C.碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
D.对于化学反应COCl2(g)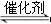 CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率
CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率
B
【解析】
试题分析:A、化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以对于一个确定的反应来说,平衡常数的数值越大,反应限度越大,A正确;B、反应条件与反应是放热反应还是吸热反应无关,铝热反应会放出大量的热,但反应需要在高温下才能发生,B不正确;C、碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,而该反应是吸热反应,所以根据△G=△H-T·△S可知,碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大,C正确;D、可逆反应COCl2(g)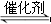 CO(g)+Cl2(g)是体积增大的放热的,因此当反应达平衡时,恒温恒压条件下通入Ar,由于容器的容积必须增大,则相当于是降低压强,所以平衡向正反应方向移动,能提高COCl2的转化率,D正确,答案选B。
CO(g)+Cl2(g)是体积增大的放热的,因此当反应达平衡时,恒温恒压条件下通入Ar,由于容器的容积必须增大,则相当于是降低压强,所以平衡向正反应方向移动,能提高COCl2的转化率,D正确,答案选B。
考点:考查反应自发性、反应热以及外界条件对平衡状态的影响

已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
①H2SO4溶液中的HSO4– | ②NaHSO4溶液中的HSO4– | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)写出H2SO4在水中的电离方程式 。
(2)常温下,题设条件下的①溶液中c(H+)= 。
(3)常温下,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是(填序号) 。
(4)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为 。
(5)根据题设条件计算CH3COOH的电离常数Ka= 。若常温下,将b mol·L–1的CH3COONa液与0.01 mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka= 。