题目内容
下列表述中正确的是
A.任何能使熵值增大的过程都能自发进行
B.△H<0,△S>0的化学反应一定能自发进行
C.已知热化学方程式2SO2(g)+O2(g) 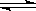 2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多
B
【解析】
试题分析:A、反应能否自发进行不单取决于熵的变化,还受反应热的影响,△G=△H-T·△S,错误;B、从△G=△H-T·△S 中可以看出,△H<0,△S>0的化学反应中,△G<0,一定能自发进行,正确;C、△H=-QkJ·mol-1Q的具体含义是:当2mol 的二氧化硫与1mol 的氧气完全反应生成2mol 的三氧化硫时,放出的热量为QkJ ,但这是一个可逆反应,不可能完全反应,因此放出的热量小于Q kJ,错误;D、1mol NaOH分别和1mol CH3COOH反应时,放出的热量其中有一小部分用于醋酸的电离,因此放出的热量总体上来说就比硝酸与氢氧化钠的反应少一点,错误。
考点:考查反应热以及反应进行的方向的判断。

已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
①H2SO4溶液中的HSO4– | ②NaHSO4溶液中的HSO4– | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)写出H2SO4在水中的电离方程式 。
(2)常温下,题设条件下的①溶液中c(H+)= 。
(3)常温下,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是(填序号) 。
(4)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为 。
(5)根据题设条件计算CH3COOH的电离常数Ka= 。若常温下,将b mol·L–1的CH3COONa液与0.01 mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka= 。
