题目内容
【题目】常温下,pH=12的氢氧化钠溶液pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
A.混合前的醋酸约1%发生电离
B.混合后的溶液中![]()
C.氢氧化钠和醋酸和浓度不相等
D.混合后的溶液呈中性
【答案】A
【解析】
A、等体积混合后,二者恰好中和,说明醋酸的浓度和氢氧化钠的浓度相同,都是0.01molL1,醋酸溶液的pH=4,则H+浓度为0.0001molL1,所以混合前醋酸电离程度为:0.0001mol/L/0.01mol/L×100%=1%,A正确;
B、因为醋酸是弱酸,反应后醋酸钠水解显碱性,所以c(Na+)>c(CH3COO),B错误;
C、由A项分析可知醋酸的浓度和氢氧化钠的浓度相同,C错误;
D、反应后醋酸钠水解显碱性,D错误。
答案选A。

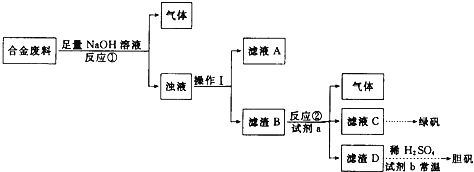
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:

(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______________。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________________。
(4)步骤Ⅲ中,加入锌粉的作用是______________。
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是_________________________________。
(6)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为______。

a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O