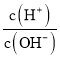题目内容
【题目】一瓶久置的Na2SO3(杂质只有Na2SO4),为了测定其纯度,取样品5.0 g配成100 mL溶液,取其中25.00 mL于锥形瓶中,用0.10 molL-1酸性KMnO4溶液进行滴定,到终点时消耗KMnO4溶液20.00 mL,求此样品的纯度。_______________
【答案】50.4%。
【解析】
先计算KMnO4的物质的量,然后根据Na2SO3与KMnO4反应的物质的量关系,计算Na2SO3的物质的量及其质量,结合样品总质量计算样品的纯度。
在20 mL样品溶液消耗n(KMnO4)=0.020 L×0.1 mol/L=0.002 mol,则100 mL样品溶液消耗n(KMnO4)=0.002mol×![]() =0.008 mol,Na2SO3与KMnO4溶液反应的方程式为:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O根据方程式可知物质的关系为n(SO32-)=
=0.008 mol,Na2SO3与KMnO4溶液反应的方程式为:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O根据方程式可知物质的关系为n(SO32-)=![]() n(KMnO4)=
n(KMnO4)=![]() =0.02 mol,根据S守恒,可知n(Na2SO3)=n(SO32-)= 0.02 mol,所以样品纯度=
=0.02 mol,根据S守恒,可知n(Na2SO3)=n(SO32-)= 0.02 mol,所以样品纯度=![]() ×100%=50.4%。
×100%=50.4%。

练习册系列答案
相关题目
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
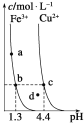
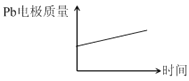
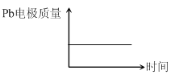
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D