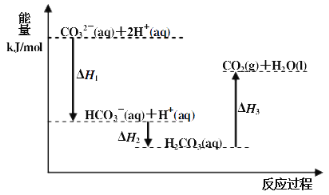
题目内容
【题目】(1)标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为__________。
(2)2L Fe2(SO4)3溶液中含Fe3+22.4g,则溶液中Fe3+的物质的量浓度为____________。
(3)现有4.4g CO2气体,在标准状况下其体积为___________,氧原子的个数为___________(用NA表示阿伏加德罗常数)
【答案】64g/mol 0.2mol/L 2.24L 0.2NA
【解析】
(1)先求出标况下672mL气体的物质的量,再利用质量1.92g求出该气体的摩尔质量。
(2)先利用Fe3+的质量22.4g求出Fe3+的物质的量,再除以体积,便得出溶液中Fe3+的物质的量浓度。
(3)先求出4.4g CO2气体的物质的量,再乘以22.4L/mol,便求出标准状况下体积;再乘以分子中所含的氧原子数,即得氧原子的个数。
(1)标况下672mL气体的物质的量n=![]() =0.03mol,再利用质量1.92g求出该气体的摩尔质量M=
=0.03mol,再利用质量1.92g求出该气体的摩尔质量M=![]() =64g/mol。答案为:64g/mol;
=64g/mol。答案为:64g/mol;
(2) Fe3+的物质的量n=![]() =0.4mol,溶液中Fe3+的物质的量浓度以c(Fe3+)=
=0.4mol,溶液中Fe3+的物质的量浓度以c(Fe3+)=![]() =0.2mol/L。答案为:0.2mol/L;
=0.2mol/L。答案为:0.2mol/L;
(3)4.4g CO2气体的物质的量n=![]() =0.1mol,标准状况下体积V=0.1mol×22.4L/mol=2.24L;氧原子的个数为0.1mol×2×NAmol-1=0.2NA。答案为:2.24L;0.2NA。
=0.1mol,标准状况下体积V=0.1mol×22.4L/mol=2.24L;氧原子的个数为0.1mol×2×NAmol-1=0.2NA。答案为:2.24L;0.2NA。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】下列实验操作能达到实验目的的是( )
选项 | 操作 | 目的 |
A | 用酚酞作指示剂,用标准的c mol·L-1盐酸滴定一定体积未知浓度的 | 测定 |
B | 将一定量 | 配制一定物质的量浓度的 |
C | 给含碎瓷片的石蜡油加强热,并将气体通入酸性高锰酸钾溶液中 | 证明气体产物含碳碳双键 |
D | 在 | 证明 |
A.AB.BC.CD.D
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
物质 | 相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置a、b的名称分别是__、__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__。
(4)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是__。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填字母)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是__(填字母)。
A.41% B.50% C.61% D.70%