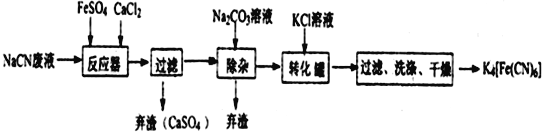
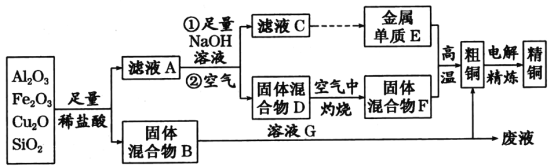
题目内容
【题目】工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4![]() 2ClO2+2NaHSO4,下列说法中正确的是
2ClO2+2NaHSO4,下列说法中正确的是
A. NaClO3在反应中失去电子
B. SO2在反应中被氧化
C. H2SO4在反应中作氧化剂
D. 1 mol氧化剂在反应中得到2 mol电子
【答案】B
【解析】
反应中Cl元素由+5价降低到+4价,被还原,NaClO3为氧化剂,S元素化合价由+4价升高到+6价,被氧化,SO2为还原剂,结合化合价的变化解答该题。
A.反应中Cl元素由+5价降低到+4价,被还原,NaClO3在反应中得到电子,故A错误;
B.S元素化合价升高,被氧化,SO2为还原剂,故B正确;
C.H2SO4在反应中没有参与氧化还原反应,仅起到酸性的作用,故C错误;
D.反应中Cl元素由+5价降低到+4价,被还原,1 mol氧化剂在反应中得到1mol电子,故D错误。
故答案选B。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目