题目内容
在相同温度下,将H2和N2两种气体按不同比例通入相同的恒容密闭容器中,发生反应:3H2+N2 2NH3。
2NH3。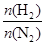 表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )
表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )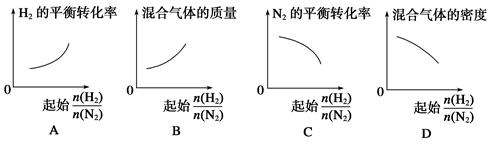
D
解析试题分析:A、起始时 的物质的量越多,
的物质的量越多,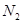 的平衡转化率越高,错误;B、起始时
的平衡转化率越高,错误;B、起始时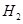 的物质的量越多,混合气体的质量越低,错误;C、错误;D、起始时
的物质的量越多,混合气体的质量越低,错误;C、错误;D、起始时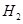 的物质的量越多,混合气体的密度越小,正确。
的物质的量越多,混合气体的密度越小,正确。
考点:混合气体。

在密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是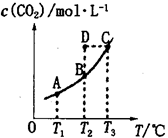
| A.平衡状态A与C相比,平衡状态A的c(CO)小 |
| B.在T2时,若反应处于状态D,则一定有v正<v逆 |
C.反应CO(g)+H2O(g) CO2(g)+H2(g)△H>0 CO2(g)+H2(g)△H>0 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
一定温度下,向aL密闭容器中加入2mol NO2(g),发生如下反应:2NO2 2NO+O2,此反应达到平衡状态的标志是
| A.混合气体的密度不再变化 |
| B.混合气体的颜色变浅 |
| C.混合气体中NO2、NO、O2的物质的量之比为2:2:1 |
| D.单位时间内生成2n mol NO同时生成2n mol NO2 |
在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )
cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )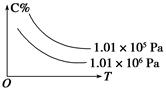
| A.ΔH<0 ΔS>0 | B.ΔH>0 ΔS<0 |
| C.ΔH>0 ΔS>0 | D.ΔH<0 ΔS<0 |
现有三个体积相等的密闭容器中都进行如下反应:CO2+H2 CO+H2O,反应所处温度相同,但反应起始的浓度不同,其中,甲:c(H2)=c(CO2)=amol/L
CO+H2O,反应所处温度相同,但反应起始的浓度不同,其中,甲:c(H2)=c(CO2)=amol/L
乙:c(CO2)=amol/L c(H2)="2" amol/L
丙:c(CO2)=c(H2)=c(H2O)=amol/L
达到平衡时,一氧化碳的浓度由大到小排列正确的是( )
| A.丙>甲>乙 | B.甲>乙>丙 | C.乙>丙>甲 | D.乙>甲>丙 |
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g)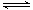 2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )
2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )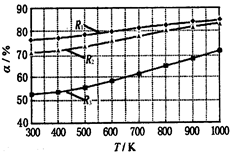
| A.该反应△H > 0 |
| B.R1对应的反应物配比为3:1 |
| C.650℃,反应物配比为1:1时,平衡常数K = 6 |
| D.该反应为取代反应 |
在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应在一定压强下,达到平衡时测得NH3的物质的量为0.6mol。若在该容器中开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为
| A.若为定容容器,n(NH3)=1.2mol | B.若为定压容器,n(NH3) >1.2mol |
| C.若为定容容器,n(NH3)>1.2mol | D.若为定压容器,n(NH3)<1.2mol |
 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
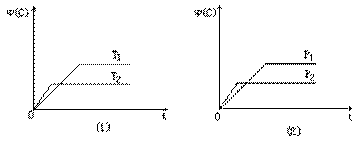
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )  eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数?(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数?(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )