题目内容
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g)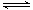 2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )
2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )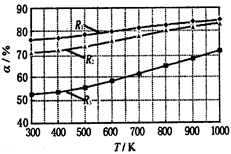
| A.该反应△H > 0 |
| B.R1对应的反应物配比为3:1 |
| C.650℃,反应物配比为1:1时,平衡常数K = 6 |
| D.该反应为取代反应 |
C
解析试题分析:A.在其它条件不变的情况下,升高温度,CH3OCOOCH3的平衡转化率增大,说明平衡正向移动。根据平衡移动原理。升高温度,化学平衡向吸热方向移动。所以正反应方向是吸热反应。该反应△H > 0.正确。B.在其它条件不变的情况下,增加反应物的浓度,可以提高其它反应物的转化率,而它本身的转化率反而降级。所以还可增大反应物中C2H5OCOOC2H5的浓度(或比例)来提高CH3OCOOCH3的平衡转化率。由于R1的转化率最高,所以R1对应的反应物配比为3:1。正确。C.650℃,反应物配比为1:1时,CH3OCOOCH3的平衡转化率α为60%.设容器的容积为VL,则开始时各物质的浓度为:C(C2H5OCOOC2H5)="1/V;" C(CH3OCOOCH3)="1/V;" C(CH3OCOOC2H5)=0.在平衡时C(C2H5OCOOC2H5)=0.4/V; C(CH3OCOOCH3)=0.4/V; C(CH3OCOOC2H5)=1.2/V.K=(1.2/V)2/(0.4/V)2=9.错误。D.由反应方程式可看出该反应为取代反应。正确。
考点:考查化学平衡的影响因素及化学平衡的计算,反应热的计算

氯气在298K、101kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数( )
| A.5.4×10—5 | B.4.5×10—4 | C.0.015 | D.无法计算 |
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol]:下列说法正确的是
2NH3(g) ΔH=-92.4 kJ/mol]:下列说法正确的是
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
| NH3的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
A.2c1>c3 B.a+b>92.4 C.2p2<p3 D.α1+α3<1
已知某可逆反应在密闭容器中进行:A(g)+2B(g)  3C(g)+D(s) △H<0,下图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
3C(g)+D(s) △H<0,下图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )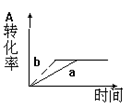
| A.增大A的浓度 | B.增大容器的体积 |
| C.加入催化剂 | D.升高温度 |
NO和CO都是汽车排放尾气中的有害物质,它们能缓慢地反应,生成N2和CO2,对此反应下列叙述正确的
| A.使用催化剂并不能改变反应速率 | B.使用催化剂可以加快反应速率 |
| C.降低压强能加快反应速率 | D.降温可以加快反应速率 |
在一定温度下可逆反应N2+3H2 2NH3已达到平衡,下列有关说法正确的 ( )
2NH3已达到平衡,下列有关说法正确的 ( )
①1个N≡N键断裂的同时,有3个H—H键形成
②反应混合物中各组分的体积分数保持不变
③恒温恒容时,容器内的压强不再改变
④1个N≡N键断裂的同时,有3个N—H 键形成
⑤NH3生成的速率与NH3分解的速率相等
⑥单位时间生成n molN2,同时生成2n molNH3
⑦气体的平均相对分子质量不再改变
⑧N2 H2 NH3的分子数一定为1∶3∶2
⑨恒温恒容时,气体的总物质的量不再改变
⑩恒温恒压时,容器内的密度不再改变
| A.①②③④⑤⑥⑦⑨ | B.①②③⑤⑥⑩ |
| C.③④⑤⑥⑦⑧ | D.①②③⑤⑥⑦⑨⑩ |
对于化学反应方向的确定,下列说法正确的
| A.反应的焓变是决定反应能否自发进行的唯一因素 |
| B.温度、压强一定时,放热反应能自发进行 |
| C.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| D.固体的溶解过程与焓变无关 |
在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g)(正反应为放热反应)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g)(正反应为放热反应)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图: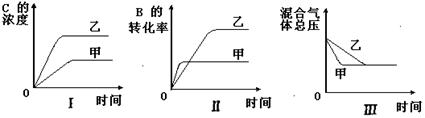
下列判断一定错误的是( )
| A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
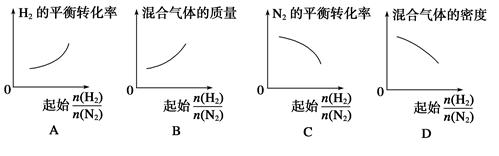
 2NH3。
2NH3。 表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )
表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )