题目内容
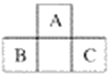
【题目】中学化学中几种常见物质的转化关系如下图所示:

已知A是一种单质,将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)写出C的溶液与双氧水反应的离子方程式:_________________。
(2)写出鉴定E中阳离子的实验方法和现象:________________。
(3)F是一种难溶物质,其溶度积常数为1.0×10-39。向D溶液中加碱调节至pH为_______时,铁离子刚好沉淀完全(离子浓度小于1.0×10-5 mol·L-1时,即可认为该离子沉淀完全)。
(4)已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99 kJ·mol-1,单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=__________kJ·mol-1。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48L CO2气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是_____________。
【答案】2Fe2++ H2O2+2H+ = 2Fe3++ 2H2O 取少量E于试管中,加入过量氢氧化钠溶液,加热,在试管口放一湿润的红色石蕊试纸,观察到红色石蕊试纸变蓝,证明E中有NH4+存在(或用蘸浓盐酸的玻璃棒靠近,若有白烟也可) 2.7 -1185 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体,说明F为Fe(OH)3,D含有铁离子,结合转化关系,可知金属单质A为Fe、B为FeS、C为FeSO4、D为Fe2(SO4)3、E为(NH4)2SO4,H为H2SO4。据此分析解答。
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体,说明F为Fe(OH)3,D含有铁离子,结合转化关系,可知金属单质A为Fe、B为FeS、C为FeSO4、D为Fe2(SO4)3、E为(NH4)2SO4,H为H2SO4。
(1)FeSO4溶液与双氧水反应生成硫酸铁,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)鉴定(NH4)2SO4中阳离子(NH4+)的实验方法和现象为:取少量E于试管中,加入过量氢氧化钠溶液,加热,在试管口放一湿润的红色石蕊试纸,观察到红色石蕊试纸变蓝,证明E中有NH4+存在,故答案为:取少量E于试管中,加入过量氢氧化钠溶液,加热,在试管口放一湿润的红色石蕊试纸,观察到红色石蕊试纸变蓝,证明E中有NH4+存在;
(3)Fe(OH)3溶度积常数为1.0×10-39。要使铁离子刚好沉淀完全,则需要满足c(Fe3+)c3(OH-)=1.0×10-39,即c(OH-)=![]() =
=![]() ×10-11mol/L≈0.5×10-11mol/L,此时pH=2.7,故答案为:2.7;
×10-11mol/L≈0.5×10-11mol/L,此时pH=2.7,故答案为:2.7;
(4)①1mol SO2(g)氧化为1mol SO3(g) ΔH= –99 kJ·mol-1,即SO2(g)+![]() O2(g)=SO3(g) △H2=-99kJmol-1;②单质硫的燃烧热为296 kJ·mol-1,则S(s)+O2(g)=SO2(g) △H1=-296kJmol-1,根据盖斯定律将②×3+①×3可得3S(s)+
O2(g)=SO3(g) △H2=-99kJmol-1;②单质硫的燃烧热为296 kJ·mol-1,则S(s)+O2(g)=SO2(g) △H1=-296kJmol-1,根据盖斯定律将②×3+①×3可得3S(s)+![]() O2(g)=3SO3(g) △H3=3×(△H1+△H2)=-1185kJmol-1,故答案为:-1185 ;
O2(g)=3SO3(g) △H3=3×(△H1+△H2)=-1185kJmol-1,故答案为:-1185 ;
(5)4.48LCO2通入到200mL1.5mol/LNaOH溶液中,二氧化碳的物质的量=![]() =0.2mol,氢氧化钠的物质的量1.5mol/L×0.2L=0.3mol。当1<
=0.2mol,氢氧化钠的物质的量1.5mol/L×0.2L=0.3mol。当1<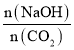 =1.5<2时,生成物是碳酸钠和碳酸氢钠,根据二氧化碳和氢氧化钠物质的量之间的关系得方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,根据方程式知,碳酸钠和碳酸氢钠的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,则c(OH-)>c(H+),碳酸根离子的水解能力大于碳酸氢根离子,所以c(HCO3-)>c(CO32-),钠离子不水解,离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+
=1.5<2时,生成物是碳酸钠和碳酸氢钠,根据二氧化碳和氢氧化钠物质的量之间的关系得方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,根据方程式知,碳酸钠和碳酸氢钠的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,则c(OH-)>c(H+),碳酸根离子的水解能力大于碳酸氢根离子,所以c(HCO3-)>c(CO32-),钠离子不水解,离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+

 阅读快车系列答案
阅读快车系列答案【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A. 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂
B. 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变
C. 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图IV所示电池工作过程中,Ag2O是氧化剂