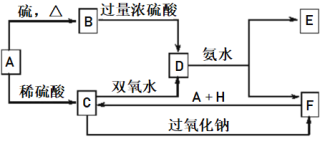
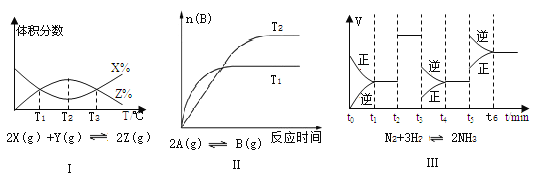
题目内容
【题目】A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:

(1)A元素气态氢化物的电子式___,A、B、C、D四种元素按原子半径由大到小的顺序排列为___。(填元素符号)
(2)A的最高价氧化物与氢氧化钠反应的离子方程式为___。
(3)A,C,D的最高价氧化物对应水化物的酸性强弱_______,C的氢化物比D的氢化物沸点___(填“高”或“低”),原因是___。
【答案】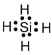 Mg>Si>P>N SiO2+2OH-=SiO32-+H2O HNO3>H2SiO3>H3PO4 高 NH3分子之间存在氢键
Mg>Si>P>N SiO2+2OH-=SiO32-+H2O HNO3>H2SiO3>H3PO4 高 NH3分子之间存在氢键
【解析】
A、B、C、D四种短周期元素,原子序数D>A>B>C,根据A的原子结构示意图可知,x=2,A的质子数为14,则A为Si元素,B元素最外层电子数是次外层电子数的四分之一,B元素原子有3个电子层,最外层电子数为2,所以B为Mg元素,C元素的气态氢化物的水溶液显碱性,则C为N元素,C、D同主族,则D为P元素,根据元素所在周期中的位置结合周期律的递变规律解答此题。
A、B、C、D四种短周期元素,原子序数D>A>B>C,根据A的原子结构示意图可知,x=2,A的质子数为14,则A为Si元素,B元素最外层电子数是次外层电子数的四分之一,B元素原子有3个电子层,最外层电子数为2,所以B为Mg元素,C元素的气态氢化物的水溶液显碱性,则C为N元素,C、D同主族,则D为P元素。
(1)由以上分析可知A为Si元素,其气态氢化物为SiH4,分子中氢原子与硅原子之间形成1对共用电子对,电子式为: ;同周期自左而右原子半径减小,同主族自上而下原子半径增大,所以A、B、C、D四种元素按原子半径由大到小的顺序排列为:Mg>Si>P>N;
;同周期自左而右原子半径减小,同主族自上而下原子半径增大,所以A、B、C、D四种元素按原子半径由大到小的顺序排列为:Mg>Si>P>N;
(2)A的最高价氧化物为SiO2,与氢氧化钠反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;
(3)元素的非金属性越强,对应最高价氧化物对应水化物的酸性越强,非金属性:N>P>Si,则酸性:HNO3> H3PO4 > H2SiO3,NH3分子之间存在氢键,所以其沸点比PH3的沸点高。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验操作对应的现象符合事实的是( )
|
|
|
|
A.将绿豆大小的金属钠投入蒸馏水中,钠块熔成小球,浮于水面,迅速游 动,溶液变红 | B.将甲烷与氯气1∶1混合,在光照条件下反应,黄绿色褪去,水面上升,充满集气瓶 | C.将5g碳酸钙投入20mL1mol·L-1盐酸,针筒活塞向右移动的速率先逐渐增大,然后减小 | D.将铜片与浓硫酸混合加热,品红溶液变红,试管内出现蓝色固体和 少量黑色物质 |
A.AB.BC.CD.D