题目内容
(14分)在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(
 )>c(
)>c( )>c(
)>c( )>c(
)>c( )>c(
)>c( )
)B.c(
 )+c(
)+c( )=c(
)=c( )+2c(
)+2c( )+c(
)+c( )
)C.c(
 )+c(
)+c( )=c(
)=c( )+c(
)+c( )
)D.两溶液中c(
 )、c(
)、c( )、c(
)、c( )分别相等
)分别相等
(每空2分)
(1)> , 1×10—12
(2) 4, 27
(3) Ba2+ + 2OH— + 2H+ + SO42— = BaSO4 ↓+ 2H2O
(4) 1:20
(5) ABC
解析试题分析:(1)t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则Kw = c(H+) ×c(OH-)=10-(a+b)=1×10-12>1×10-14,所以t>25;
(2)未加入硫酸氢钠溶液的Ba(OH)2的稀溶液pH=8,说明Ba(OH)2的稀溶液中c(H+)=10-8 mol/L,则a=8,b=4;33mL的Ba(OH)2的稀溶液加入xmL的pH=4的NaHSO4后pH=7,说明此时溶液显碱性,则c(OH-)×V(Ba(OH)2)- c(H+)×x=1×10-12/1×10-7×(x+33),解得x=27;
(3)反应③是等体积的Ba(OH)2溶液与NaHSO4溶液反应,混合后溶液呈中性,所以离子方程式为Ba2+ + 2OH— + 2H+ + SO42— = BaSO4 ↓+ 2H2O
(4)Ba(OH)2是强碱,1mL的Ba(OH)2溶液中c(Ba2+)="0.5" c(OH-)=1/2×10-4mol/L,稀释1000倍后,c(Ba2+)=5×10-8mol/L,c(OH-)=1×10-7mol/L< c(H+),碱溶液中不可能存在c(OH-) < c(H+),所以此时稀释后的溶液中氢氧根离子浓度按纯水计算,c(OH-)=1×10-6mol/L,则c(Ba2+)﹕c(OH-)= 5×10-8mol/L/1×10-6mol/L=1:20;
(5)NaHSO3溶液呈酸性,说明HSO3-的电离程度大于其水解程度;NaHCO3溶液呈碱性,说明HCO3-的水解程度大于其电离程度。A、若R是S元素,则c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-),正确;B、无论R是哪种元素,都符合电荷守恒规律,正确;C、无论R是哪种元素,都符合物料守恒规律,c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),与c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-)相结合,即得
c(H+)+c(H2RO3)=c(RO32-)+c(OH-),正确;D、两溶液中c(Na+)相等,NaHSO3溶液c(RO32-)较大,但c(HRO3-)无法判断,错误,凳矮矮选ABC。
考点:考查水离子积的比较,混合溶液的计算,离子浓度的比较,守恒规律的应用

下列有关电解质溶液中微粒的关系不正确的是
| A.25℃时,pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.25℃时,pH=3的氯化铵溶液中: c(OH-)=1.0×10-11mol·L-1 |
| C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 |
| D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+) = c(SO42-) >c(NH4+) >c(H+) > c(OH-) |
能说明醋酸是弱电解质的事实是:
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5
| A.①③④ | B.①② | C.②④ | D.② |
(6分)水溶液中存在水的电离平衡。
(1)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于 。
(2)用“>”、“<”或“=”填空: 碱性溶液中,c(H+) c(OH-),在常温时pH 7。
(3)有下列几种溶液:
| A.NH3·H2O | B.CH3COONa | C.NH4Cl | D.NaHSO4 |
用离子方程式或电离方程式表示这些溶液呈酸性的原因:___________________________________。
锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。
某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
(1)酸洗时,为使水垢尽可能溶解,不宜选用的是 (填标号)。
| A.醋酸 | B.盐酸 | C.硝酸 | D.稀硫酸 |
(3)洗出液中的Fe3+会腐蚀铁质管道,反应的离子方程式是 ,因此,常在洗出液中加入具有强还原性的SnCl2溶液,反应中的Sn2+与Fe3+的物质的量之比为1∶2,Sn2+转化为 (填离子符号)。
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图
所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 。
调节柠檬酸溶液的pH=4,有利于除去水垢中的氧化铁。pH=4时,溶液中上述4种微粒含量最多的是 。

【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: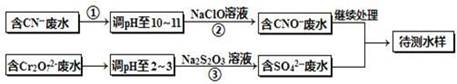
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
| A.x ="0.5" ,a =8 | B.x =0.5,a = 10 |
| C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |


 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
 (Ni(OH)
(Ni(OH) ): 5.0×10-16 ,K
): 5.0×10-16 ,K