题目内容
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。②K (Ni(OH)
(Ni(OH) ): 5.0×10-16 ,K
): 5.0×10-16 ,K (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物之一 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀?
。
(1)碳粉
(2)Fe(OH)3、Al(OH)3 把干燥pH试纸置于表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取待测液滴在pH试纸上,待显色后立即与标准比色卡比对即可读数。
(3) NiCl2+Na2C2O4==NiC2O4↓+2NaCl
(4) NiC2O4 +2OH- 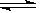 Ni(OH)2+C2O42- 8.0×105L.mol-1
Ni(OH)2+C2O42- 8.0×105L.mol-1
(5) Cl2 往盛有Ni(OH)3 沉淀的漏斗中注入蒸馏水至浸没沉淀,待水自然流干后,再重复2~2次。
解析试题分析:(1)由于电极材料是由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成的,因此在这些成分中不溶于酸的只有碳粉,所以酸溶后所留残渣为碳粉。
(2)酸溶后的溶液中含有Al3+ 、Fe3+ 、Ni2+ 等金属离子,因此加入NiO主要是调节pH值使杂质离子Al3+ 、Fe3+ 沉淀,所以析出的沉淀为Fe(OH)3、Al(OH)3 。用pH试纸测定溶液pH值的操作是:把干燥pH试纸置于表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取待测液滴在pH试纸上,待显色后立即与标准比色卡比对即可读数。
(3)除去Al3+ 、Fe3+ 等杂质离子后的溶液为NiCl2 溶液,加入Na2C2O4溶液后又经过了过滤步骤,可以推测此步骤中反应有沉淀析出,因此发生的反应方程式为NiCl2+Na2C2O4==NiC2O4↓+2NaCl。
(4)加NaOH溶液到NiC2O4 沉淀中,根据已知条件中Ni(OH) 、NiC2O4的溶度积,可以分析两种沉淀的溶解度较接近,因此此处应该是发生了沉淀的转化反应,所以方程式为NiC2O4 +2OH-
、NiC2O4的溶度积,可以分析两种沉淀的溶解度较接近,因此此处应该是发生了沉淀的转化反应,所以方程式为NiC2O4 +2OH- 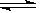 Ni(OH)2+C2O42- ,此转化方程式可由两沉淀的溶解平衡式结合而得:
Ni(OH)2+C2O42- ,此转化方程式可由两沉淀的溶解平衡式结合而得:
①Ni(OH)2 = Ni2+ +2OH- K (Ni(OH)
(Ni(OH) )= 5.0×10-16 ②NiC2O4 = Ni2+ + C2O42- K
)= 5.0×10-16 ②NiC2O4 = Ni2+ + C2O42- K (NiC2O4)=4.0×10-10 ,
(NiC2O4)=4.0×10-10 ,
由所求方程式可由②—①得,因此该式的平衡常数K=K (NiC2O4)/ K
(NiC2O4)/ K (Ni(OH)
(Ni(OH) )= 8.0×105L.mol-1 。
)= 8.0×105L.mol-1 。
(5)过滤1后的滤液是氯化钠溶液,因此电解氯化钠溶液能得到氧化性的气体氯气。洗涤Ni(OH)3 沉淀的操作是:往盛有Ni(OH)3 沉淀的漏斗中注入蒸馏水至浸没沉淀,待水自然流干后,再重复2~3次。
考点:本题考查的是简单的化学工艺流程题,考查的操作较多。

 阅读快车系列答案
阅读快车系列答案如表为有关化合物的pKsp,pKsp=-lgKsp。某同学设计实验如下:①向AgNO3溶液中加入适量NaX溶液,得到沉淀AgX;②向①中加NaY,则沉淀转化为AgY;③向②中加入NaZ,沉淀又转化为AgZ。则表中a、b、c的大小关系为( )
| 相关化合物 | AgX | AgY | AgZ |
| pKsp | a | b | c |
A.a>b>c B.a<b<c C.c<a<b D.a+b=c
(14分)在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(
 )>c(
)>c( )>c(
)>c( )>c(
)>c( )>c(
)>c( )
)B.c(
 )+c(
)+c( )=c(
)=c( )+2c(
)+2c( )+c(
)+c( )
)C.c(
 )+c(
)+c( )=c(
)=c( )+c(
)+c( )
)D.两溶液中c(
 )、c(
)、c( )、c(
)、c( )分别相等
)分别相等 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA | NaOH | 混合溶液的pH |
| 甲 | [HA]=0.2 mol·L-1 | [NaOH]=0.2 mol·L-1 | pH=a |
| 乙 | [HA]=c1 mol·L-1 | [NaOH]=0.2 mol·L-1 | pH=7 |
| 丙 | [HA]=0.1 mol·L-1 | [NaOH]=0.1 mol·L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?________________________________________________
(2)c1________(填“<”、“>”或“=”)0.2 mol·L-1。乙组实验中HA和NaOH溶液混合前,HA溶液中[A-]与NaOH溶液中[Na+]的关系是________(从下面选项中选择填空)。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是__________________________,其中,[A-]=________ mol·L-1(不能做近似计算,回答准确值,结果不一定要化简)。
(4)丁组实验中,HA和NaOH溶液混合前[HA]________(填“<”、“>”或“=”)[NaOH],b________(填“<”、“>”或“=”)7。

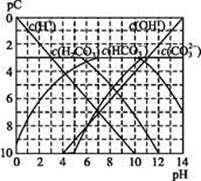
 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。  ≈ 。
≈ 。  不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。  )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。