题目内容
12.如图是硫酸试剂瓶标签上的部分内容.据此下列说法中,正确的是( )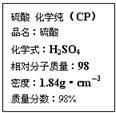
| A. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL | |
| B. | 1 mol Zn与足量的该硫酸反应产生2 g H2 | |
| C. | 该硫酸可以用来干燥硫化氢气体 | |
| D. | 若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗 |
分析 A.根据c=$\frac{1000ρω}{M}$计算出该硫酸的浓度,再根据稀释过程中溶质的物质的量不变计算出需要该硫酸的体积;
B.该硫酸为浓硫酸,浓硫酸与锌反应生成的是二氧化硫,不会生成氢气;
C.浓硫酸具有强氧化性,能够氧化硫化氢气体;
D.氢氧化钠具有很强腐蚀性,不能用氢氧化钠溶液冲洗.
解答 解:A.溶液稀释前后溶质的物质的量不变,该浓硫酸浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制200mL4.6mol/L的稀硫酸需取该硫酸体积=$\frac{4.6mol/L×0.2L}{18.4mol/L}$=0.05L=50mL,故A正确;
B.该硫酸为浓硫酸,浓硫酸具有强氧化性,与锌反应不会生成氢气,故B错误;
C.浓硫酸具有强氧化性,能够氧化硫化氢,不能用该硫酸干燥硫化氢气体,故C错误;
D.若不小心将该硫酸溅到皮肤上,应该立刻用大量水冲洗,然后涂上稀的碳酸氢钠溶液,由于氢氧化钠具有腐蚀性,不能用氢氧化钠溶液冲洗,故D错误;
故选A.
点评 本题考查物质的量浓度的有关计算,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O.对于该反应,下列说法正确的是( )
| A. | 该反应是置换反应 | |
| B. | 该反应只有K2FeO4为氧化产物 | |
| C. | 3mol氯气参与反应转移电子数为6个 | |
| D. | 该反应条件下K2FeO4的氧化性大于Cl2 |
3.下列说法正确的是( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | 硫化亚铁溶于稀硝酸中的离子方程式为:FeS+2H+═Fe2++H2S↑ | |
| D. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+能够大量共存 |
20.在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(s)+2B(g)?C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值.
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值.
| A. | ②③⑤ | B. | ①②③ | C. | ②③④⑥ | D. | ①③④⑤ |
17.磷酸铁锂(LiFePO4)电池是可循环使用的二次电池,其循环寿命是铅蓄电池的4-7倍,并有大容量、无记忆效应等优点,可用于电动汽车.该电池的正极材料是LiFePO4,负极材料是锂,电池反应为:LiFePO4$?_{放电}^{充电}$ FePO4+Li,使用含Li+导电固体为电解质.下列有关LiFePO4电池说法正确的是( )
| A. | 可加入硫酸、氢氧化钾等强电解质以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 放电过程中,电池正极材料的质量不变 | |
| D. | 放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
4.物质的量之比为1:3的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是( )
| A. | 在此反应中硝酸体现强氧化性,全部被还原 | |
| B. | 向反应后的溶液中再加入金属铁,不再发生化学反应 | |
| C. | 原混合物在反应后,被还原的硝酸与未被还原的硝酸之比为1:4 | |
| D. | 原混合物在反应后,被还原的硝酸与未被还原的硝酸之比为1:5 |
1.下列物质暴露于空气中,其质量改变和空气中的成分没有关系的是( )
| A. | 生石灰 | B. | 铁粉 | C. | 浓硫酸 | D. | 浓盐酸 |
