题目内容
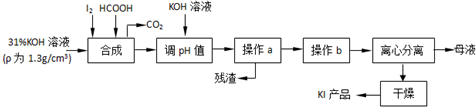
2.某无色溶液X,由K+、Ba2+、Al3+、Fe3+、AlO2-、CO32-、SO42-中的若干种离子组成,取溶液进行如图实验:
(1)气体A的成分是CO2(填化学式,下同),气体B的成分是NH3.
(2)确定溶液中没有Al3+的理由是CO32-与Al3+发生双水解反应.
(3)分别写出形成白色沉淀甲和气体B的离子方程式Al3++3HCO3-=Al(OH)3↓+3CO2↑、OH-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(4)通过上述实验,可确定X溶液中一定存在的离子是K+、CO32-、AlO2-,尚未确定是否存在的离子是SO42-,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是在沉淀乙中加足量的稀盐酸,若沉淀全部溶解则说明只有BaCO3,则溶液中不存在SO42-,若不能全部溶解,说明是BaCO3和BaSO4的混合物,则溶液中一定含有SO42-.
分析 无色溶液中一定不存在有色的Fe3+;X中进入过量盐酸后生成气体A,气体A只能为CO2,则X中一定含有CO32-,根据离子共存,则一定不存在Ba2+、Al3+、Fe3+;溶液Ⅰ中进入过量碳酸氢铵溶液后生成气体A、白色沉淀甲和溶液Ⅱ,说明碳酸氢根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,则白色沉淀甲为氢氧化铝沉淀,原溶液中一定存在AlO2-;溶液Ⅱ中含有碳酸氢根离子、铵根离子,进入过量氢氧化钡溶液后生成的气体B为NH3,白色沉淀乙中一定含有BaCO3,可能含有BaSO4,根据溶液电中性可知,原溶液中一定含有K+,据此进行解答.
解答 解:无色溶液中一定不存在有色的Fe3+;X中进入过量盐酸后生成气体A,气体A只能为CO2,则X中一定含有CO32-,根据离子共存,则一定不存在Ba2+、Al3+、Fe3+;溶液Ⅰ中进入过量碳酸氢铵溶液后生成气体A、白色沉淀甲和溶液Ⅱ,说明碳酸氢根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,则白色沉淀甲为氢氧化铝沉淀,原溶液中一定存在AlO2-;溶液Ⅱ中含有碳酸氢根离子、铵根离子,进入过量氢氧化钡溶液后生成的气体B为NH3,白色沉淀乙中一定含有BaCO3,可能含有BaSO4,根据溶液电中性可知,原溶液中一定含有K+,
(1)根据分析可知,气体A为CO2,气体B的成分是NH3,
故答案为:CO2;NH3;
(2)溶液中存在CO32-,而CO32-与Al3+发生双水解反应,则原溶液中一定不存在Al3+,
故答案为:CO32-与Al3+发生双水解反应;
(3)白色沉淀甲为氢氧化铝,氨气B为氨气,反应的离子的方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑、OH-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;OH-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(4)根据分析可知,溶液中一定存在的离子为:K+、CO32-、AlO2-;
溶液中一定含有碳酸根离子,也可能含有SO42-,所以加过量的氢氧化钡生成白色沉淀一定含有碳酸钡,可能有硫酸钡,确定是否含有SO42-的方法为:在沉淀乙中加足量的稀盐酸,若沉淀全部溶解则说明只有BaCO3,则溶液中不存在SO42-,若不能全部溶解,说明是BaCO3和BaSO4的混合物,则溶液中一定含有SO42-,
故答案为:K+、CO32-、AlO2-;在沉淀乙中加足量的稀盐酸,若沉淀全部溶解则说明只有BaCO3,则溶液中不存在SO42-,若不能全部溶解,说明是BaCO3和BaSO4的混合物,则溶液中一定含有SO42-.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及逻辑推理能力.

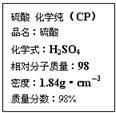
| A. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL | |
| B. | 1 mol Zn与足量的该硫酸反应产生2 g H2 | |
| C. | 该硫酸可以用来干燥硫化氢气体 | |
| D. | 若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗 |
| A. | Na+、H+、SO42-、OH- | B. | Na+、Cu2+、NO3-、Cl- | ||
| C. | H+、Ca2+、Cl-、NO3- | D. | Ag+ Na+、NO3-、Cl-、 |
| A. | 可以用单位时间内CaCO3质量的减少表示该反应的反应速率 | |
| B. | 可以用单位时间内生成H2的物质的量表示该反应的反应速率 | |
| C. | 可以用单位时间内溶液中Ca2+浓度的增加表示该反应的反应速率 | |
| D. | 可以用单位时间内CaCO3浓度的变化表示该反应的反应速率 |
| A. | 一定相等 | B. | 一定不相等 | C. | 不一定相等 | D. | 不能确定 |
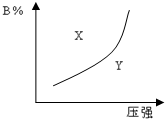 mA(g)+nB(g)?pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图中实线所示,有关叙述正确的是( )
mA(g)+nB(g)?pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图中实线所示,有关叙述正确的是( )| A. | m+n>p | B. | x点的速率关系为v正>v逆 | ||
| C. | n>p | D. | x点比y点混合物反应速率快 |
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能∕(kJ•mol-1) | 436 | 243 | 431 |
| A. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=-91.5 kJ•mol-1 | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183 kJ•mol-1 | |
| C. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=+91.5 kJ•mol-1 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ•mol-1 |