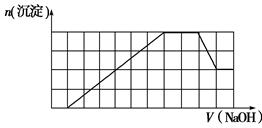
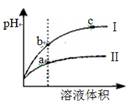
题目内容
某无色溶液中含有:①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
根据上述实验现象,判断以下结论中正确的是( )
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑤
C.可能含有的离子是①②⑥
D.不能确定的离子是①③⑥
根据上述实验现象,判断以下结论中正确的是( )
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4,振荡,静置 | CCl4层呈橙红色 |
| ③ | 取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑤
C.可能含有的离子是①②⑥
D.不能确定的离子是①③⑥
A
步骤①说明溶液中存在SO32-,Ba2+、SO32-不能共存,所以无Ba2+,而溶液中有阴离子就必然存在阳离子,故溶液中肯定存在Na+。步骤②可证明溶液中存在Br-。步骤③不能证明原溶液中含有SO42-,因为SO42-可能来自于SO32-的氧化。步骤④也不能证明原溶液中存在Cl-,因为滤液中的Cl-可能来自于步骤②中加入的氯水。

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
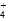 ]∶[SO
]∶[SO ]
]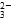 ]
]