题目内容
25℃时,0.1mol·L-1CH3COONa溶液pH=a,则
| A.该温度下,CH3COOH的Ka=1014-2a |
| B.该温度下,上述溶液中水的电离度α=(1.8×l0 a -14)% |
| C.升高温度,溶液中c(H+)增大,水解平衡常数K也增大 |
| D.加水稀释,CH3COONa水解程度增大,C(OH-)增大 |
B
试题分析:A、CH3COONa平衡为CH3COO-+H2O
 CH3COOH+ OH-
CH3COOH+ OH-0.1 10-14+a 10-14+a
k= c(CH3COOH)×c(OH-)/ c(CH3COO-)=10-14+a×10-14+a/0.1=10-27+2a
ka= c(CH3COO-)×c(H+)/ c(CH3COOH)
= c(CH3COO-)×c(H+)×c(OH-)/ c(CH3COOH) ×c(OH-)
=kw÷k=10-14÷10-27+2a=1013-2a
错误;
B、水电离出的c(OH-)=10-14+a,所以水的电离度为10-14+a/(1000÷18)=(1.8×l0 a -14)%,正确;
C、升高温度,水解程度增大,氢氧根离子浓度增大氢离子浓度减小,错误;D、加水稀释,水解程度增大,但C(OH-)减少,错误。

练习册系列答案
相关题目
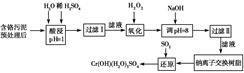
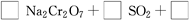
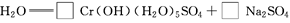 ;
;