题目内容
2.设NA为阿伏伽德罗常数的值,下列有关叙述不正确的是( )| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol 甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有 数为NA 数为NA | |
| D. | 1mol碳正离子(CH${\;}_{3}^{+}$)所含的电子总数为8NA |
分析 A.气体摩尔体积使用对象为气体;
B.1个甲基含有9个电子;
C.1,3-丁二烯分子中含有2个碳碳双键;
D.碳正离子中含有8个电子,1mol碳正离子中含有8mol电子.
解答 解:A.标况下,庚烷为液体,不能使用气体摩尔体积,故A错误;
B.1mol甲基(-CH3)所含的电子总数=(6+3)×NA=9NA,故B正确;
C.1,3-丁二烯分子中含有2个碳碳双键,0.5mol 1,3-丁二烯分子中含有C=C双键数为NA,故C正确;
D.1mol碳正离子(CH3+)中含有8mol电子,所含的电子总数为8NA,故D正确;
故选:A.
点评 本题考查阿伏加德罗常数的应用,注意明确分子、原子、原子核内质子中子及核外电子的构成关系,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间关系是解题关键,题目难度不大.

练习册系列答案
相关题目
12.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )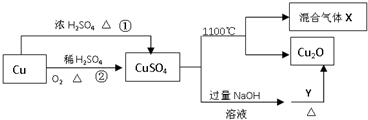

| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是酒精溶液 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 |
13.用铝箔包裹0.1mol金属钠,用针刺出一些小孔,放入水中,完全反应后,产生的气体的体积为(标准状况)( )
| A. | 小于1.12L | B. | 1.12L | ||
| C. | 在1.12L和4.48L之间 | D. | 大于4.48L |
17.既是分解反应又是氧化还原反应的是( )
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2HI$\frac{\underline{\;高温\;}}{\;}$H2+I2 | ||
| C. | H2O+SO2═H2SO3 | D. | Fe2O2+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
7.在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H=a kJ•mol-1
其化学平衡常数K和温度T的关系如下表所示:
则下列有关叙述正确的是( )
其化学平衡常数K和温度T的关系如下表所示:
| T(℃) | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| A. | a>0 | |
| B. | 可测量容器总压变化来判定化学反应是否达到平衡 | |
| C. | 温度为830℃时,若c(CO2)•c(H2)>c(CO)•c(H2O),此时还未达平衡 | |
| D. | 温度不变,增大c(CO2),平衡右移,K增大 |
11.已知C5H10O能发生银镜反应,该有机物的同分异构体有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
19.关于吸热反应、放热反应的叙述正确的是( )
| A. | Ba(OH)2+H2SO4═BaSO4↓+2H2O既是放热反应又是氧化还原反应 | |
| B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O反应物的总能量低于生成物的总能量 | |
| C. | C(石墨)$\frac{一定条件}{\;}$C(金刚石)是吸热反应,所以金刚石比石墨更稳定 | |
| D. | 吸热反应和放热反应都遵守能量守恒定律 |