题目内容
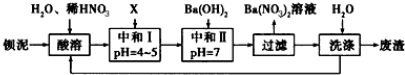
14.有一包白色粉末可能含有Na2SO4、Na2CO3、KCl、Ba(NO3)2、CuSO4中的一种或几种,按以下步骤进行实验:(1)将固体粉末溶于水得无色溶液和白色沉淀;
(2)加入稀盐酸,沉淀部分溶解且有气泡产生.
(3)在(2)的滤液中加入硝酸酸化的硝酸银有白色沉淀.
根据以上实验所产生得现象,判断这种混合物里,一定含有Na2CO3、Na2SO4、Ba(NO3)2,一定没有CuSO4,可能有的物质是KCl; 写出前两步所发生反应的离子方程式:SO42-+Ba2+═BaSO4↓,CO32-+Ba2+═BaCO3↓,BaCO3+2H+═Ba2++CO2+H2O.
分析 (1)将固体粉末溶于水得无色溶液和白色沉淀,溶液为无色,说明一定不存在蓝色的CuSO4;有白色沉淀,可能含有碳酸钠或硫酸钠、硝酸钡;
(2)加入稀盐酸,沉淀部分溶解且有气泡产生,沉淀只有部分溶解,说明沉淀为碳酸钙和硫酸钡,溶液中一定存在Na2SO4、Na2CO3、Ba(NO3)2;
(3)在(2)的滤液中加入硝酸酸化的硝酸银有白色沉淀,沉淀是氯化银,但是加入的盐酸中存在氯离子,所以是否存在氯化钾无法判断,根据以上分析判断未知物的组成.
解答 解:(1)将固体粉末溶于水得无色溶液和白色沉淀,溶液为无色,说明一定不存在蓝色的CuSO4;有白色沉淀,可能含有碳酸钠或硫酸钠、硝酸钡;
(2)加入稀盐酸,沉淀部分溶解且有气泡产生,沉淀只有部分溶解,说明沉淀为碳酸钙和硫酸钡,溶液中一定存在Na2SO4、Na2CO3、Ba(NO3)2;
(3)在(2)的滤液中加入硝酸酸化的硝酸银有白色沉淀,沉淀是氯化银,但是加入的盐酸中存在氯离子,所以是否存在氯化钾无法判断,
根据以上实验所产生得现象,判断这种混合物里,一定含有Na2CO3、Na2SO4、Ba(NO3)2,一定没有CuSO4,可能有的物质是KCl;前两步所发生反应的离子方程式为:SO42-+Ba2+═BaSO4↓,CO32-+Ba2+═BaCO3↓,BaCO3+2H+═Ba2++CO2+H2O.
故答案为:Na2CO3、Na2SO4、Ba(NO3)2;CuSO4;KCl;SO42-+Ba2+═BaSO4↓,CO32-+Ba2+═BaCO3↓,BaCO3+2H+═Ba2++CO2+H2O.
点评 本题考查了未知物的检验,题目难度中等,注意掌握检查物质的检验方法,明确溶液为有色的常见物质名称,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | A+X-n | B. | A-X-n | C. | A+X+n | D. | A-X+n |
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol 甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有 数为NA 数为NA | |
| D. | 1mol碳正离子(CH${\;}_{3}^{+}$)所含的电子总数为8NA |
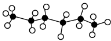 ,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是( )
,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是( )| A. | X分子中可能含有三个甲基 | |
| B. | X的一氯代物一定有三种 | |
| C. | 在催化剂存在下加热正己烷时可得到丁烷、丙烷、乙烯、丙烯等物质 | |
| D. | X能使溴的四氯化碳溶液褪色 |
| A. | 核电荷为12的原子 | B. | 质子数为8的原子 | ||
| C. | K层为最外层时有2个电子的原子 | D. | 核电荷数为9的原子 |
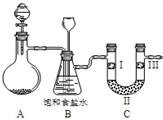 某学习小组围绕氯气设计了系列实验.
某学习小组围绕氯气设计了系列实验.(1)用如图装置A制备氯气.选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口活塞(或将漏斗口活塞上的凹槽与瓶口上的小孔对齐),左手顶住漏斗球,右手转动颈部活塞控制加液.
(2)装置B中饱和食盐水的作用是除去氯气中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗下端导管中液面会上升,形成水柱.
(3)为检验氯气是否具有漂白性,使氯气依次通过I、Ⅱ、Ⅲ三种物质,物质的顺序正确的是:D.
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
A.水层显棕黄色 B.水层无色 C.四氯化碳层显红棕色 D.四氯化碳层无色
(5)查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质
(6)有人提出,工业上为防止污染空气,可用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O).判断改用NaHSO3溶液是否可行:否(填“是”或“否”).