题目内容
7.某原电池的总反应是:Zn+Cu2+═Zn2++Cu,此反应的原电池的正确组成是( )| 正极 | 负极 | 电解质溶液 | |
| A | Cu | Zn | HCl |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuSO4 |
| D | Cu | Zn | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据电池反应式知,失电子的金属作负极,则锌作负极,不如负极活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,所以电解质溶液中含有铜离子,则电解质溶液为可溶性的铜盐.
解答 解:根据电池反应式知,锌失电子发生氧化反应而作负极,不如锌活泼的金属或导电的非金属作正极,铜离子在正极上得电子发生还原反应,则电解质为可溶性的铜盐,符合条件的是C,故选C.
点评 本题考查了原电池工作原理,判断正负极、电解质溶液时,要根据电池反应式判断:发生氧化反应的电极为负极,发生还原反应的电极为正极,含有发生还原反应的离子溶液为电解质溶液.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
17.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 18gD2O含有10NA个质子 | |
| C. | 标准状况下,2.24L CCl4中含有C-Cl 0.4 NA | |
| D. | 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA |
2.硫酸是重要的化工产品,目前主要采用“接触法”进行生产.有关接触氧化反应2SO2+O2?2SO3(该反应为放热反应)的说法中正确的是( )
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 | |
| C. | 温度越高反应速率越快,平衡时生成的SO3越多 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
12.下列说法中不正确的是( )
| A. | 用石灰石-石膏法可以消除燃煤烟气中的二氧化硫,同时还得到副产品石膏(CaSO3•2H2O)和亚硫酸铵 | |
| B. | 利用太阳能光电转化材料组装的器件,只要光电转化效率都达到10%,利用太阳投射到地球上能量的0.1%就能满足当前全世界能源需要 | |
| C. | 借助扫描隧道显微镜,能实现对原子或分子的操纵 | |
| D. | 道尔顿提出的原子学说、阿伦尼乌斯创立的电离学说、门捷列夫提出的元素周期律都对化学学科的发展作出了重要的贡献 |
19.有A、L、Z、W、Q五种短周期元素,其中Z、Q同主族,A、L、Z、W同周期;A+与Q2-具有相同的电子层结构; L的单质晶体熔点高、硬度大,是一种重要的半导体材料;离子半径:Z2->W-.下列说法中,正确的是( )
| A. | 元素L、Z、W的单质晶体属于同种类型的晶体 | |
| B. | 由于W、Z、Q元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| C. | A、Q两种元素能形成A2Q和A2Q2型化合物 | |
| D. | 元素W和Q的某些单质不可以作为水处理中的消毒剂 |
16.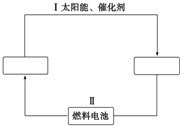 氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )
氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )
 氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )
氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )| A. | 氢能转化为化学能 | B. | 化学能转化为电能 | ||
| C. | 太阳能转化为热能 | D. | 电能转化为化学能 |
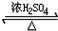 CH3COOCH2CH2CH3+H2O.
CH3COOCH2CH2CH3+H2O.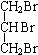 +3NaOH$→_{△}^{H_{2}O}$
+3NaOH$→_{△}^{H_{2}O}$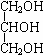 +3NaBr.
+3NaBr.
 四种有机物,且相对分子质量大小关系为B>C>D.则B、C、D 的结构简式分别是:
四种有机物,且相对分子质量大小关系为B>C>D.则B、C、D 的结构简式分别是: ;CCH3COOH;DHCOOH.
;CCH3COOH;DHCOOH. .
. .
.