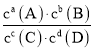题目内容
【题目】硫及其化合物在现代生产和生活中发挥重要作用。
(1)可以通过热化学循环在较低温度下由硫化氢分解制备氢气。
SO2(g)+I2(s)+2H2O(1)==2HI(aq)+H2SO4(aq) △H1=—151.5kJ·mol-1
2HI(aq)==H2(g)+I2(s) △H2=+110kJ·mol-1
H2S(g)+H2SO4(aq)==S(s)+SO2(g)+2H2O(I) △H3=+65kJ·mol-1
热化学硫碘循环硫化氢分解联产氢气、硫磺的热化学方程式为_________________。
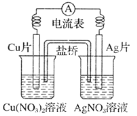
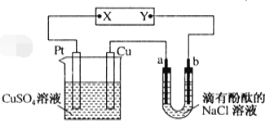
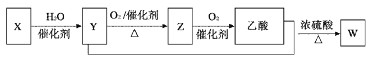
(2)硫酸厂尾气中含有大量SO2,为提高其利用率可用图1所示装置(电极均为惰性电极)将其吸收,而锂—磺酰氯(Li—SO2C12)电池可作为电源电解制备Ni(H2PO2)2(图2)。已知电池反应为:2Li+SO2C12=2LiCl+SO2↑
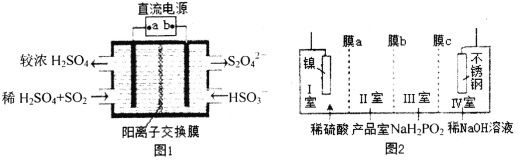
①图1中:a为直流电源的______极(填“负”或“正”),其阴极的电极反应式为_____。
②SO2C12分子中S原子的杂化方式为____________________。
③锂—磺酰氯电池的正极反应式为_______________________。
④图2中膜a为______交换膜(填“阳离子”或“阴离子”下同),膜c为_________交换膜。不锈钢电极的电极反应式为_______________________________。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g) ![]() 2SO3(g)。
2SO3(g)。
已知:标准平衡常数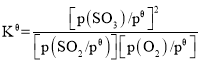 ,其中
,其中![]() 为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为![]() ,则
,则![]() _______(用含
_______(用含![]() 的最简式表示)。
的最简式表示)。
【答案】H2S(g) =H2(g)+S(s) △H=+23.5 kJ ·mol-1 正 2HSO3-+2e-+2H+= S2O42-+2H2O sp3 SO2Cl2+2e-=2Cl-+SO2↑ 阳离子 阳离子 2H2O+2e-=H2↑+2OH- ![]()
【解析】
(1)根据已知焓变的热化学方程式推导所求反应,再根据盖斯定律求△H;
(2)①根据图1右边的S元素化合价变化判断极性,当原电池与电解池相连时,电源正极与电解池阳极相连,即可判断电极a极性;由于阴极为HSO3-放电生成S2O42-,根据电极反应式书写技巧书写电极反应式;
②根据SO2Cl2中S原子的电子排布,结合电子式可知,S原子最外层无孤对电子,即可知S原子的杂化方式;
③先写出锂-磺酰氯电池的负极反应式,利用总反应减去负极反应式即可得出正极反应式;
④结合交换膜的作用:只允许某种离子通过,目的为促进某种产物的生成,由于电解目的为制备Ni(H2PO2)2,则Ⅰ室镍电极需放电溶解作阳极,产生的镍离子需要进入Ⅱ室形成产品,即可知膜a的类型,不锈钢作阴极,需要H+放电,则Ⅲ室中的H+需移向Ⅳ室,不锈钢电极为水中的H+放电产生H2,结合电极反应式书写技巧可得不锈钢电极的电极反应式;
(3)由于SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则可得出SO3的变化量为2ω,列三段式,分别求出平衡时各物质的分压,代入标准平衡常数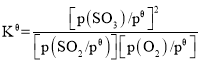 中即可的结果。
中即可的结果。
(1)反应③+反应①可消去H2SO4,最后再加上反应②消去I2即可得出硫化氢分解联产氢气、硫磺的热化学方程式,H2S(g)═H2(g)+S(s)△H,结合盖斯定律:△H=△H3+△H1+△H2=65kJ·mol-1+110kJ·mol-1-151.5kJ·mol-1=+23.5kJ·mol-1,故答案为:H2S(g)═H2(g)+S(s)△H=+23.5kJ·mol-1;
(2)①由图1可知,右边电极反应为HSO3-反应生成S2O42-,S元素化合价降低,所以右边为电解池的阴极,左边则为电解池的阳极,又因为阳极与电源正极相连,所以a为直流电源的正极,结合电极方程式书写原则:电子转移守恒、电荷守恒;阴极的电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O,故答案为:正;2HSO3-+2e-+2H+=S2O42-+2H2O;
②SO2Cl2分子中S原子无孤对电子,所以S原子的杂化方式为sp3,故答案为:sp3;
③锂-磺酰氯电池的负极为Li-e-=Li+,已知电池反应为:2Li+SO2Cl2═2LiCl+SO2↑,则总反应-负极反应即可得出正极反应为:SO2Cl2+2e-═2Cl-+SO2↑,故答案为:SO2Cl2+2e-═2Cl-+SO2↑;
④根据电解目的:制备Ni(H2PO2)2,可知Ⅰ室中的镍电极做阳极放电溶解形成Ni2+,Ni2+需要向右移动进入产品室形成产品,所以膜a为阳离子交换膜,不锈钢为电解池阴极,需要溶液中的阳离子放电,则Ⅲ室中的H+主要通过阳离子交换膜进入Ⅳ室,所以膜c为阳离子交换膜,不锈钢的电极反应为H2O中的H+放电产生H2,电极反应式为:2H2O+2e-═H2↑+2OH-,故答案为:阳离子;阳离子;2H2O+2e-═H2↑+2OH-;
(3)已知:标准平衡常数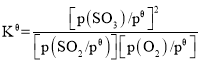 ,整理得Kθ=
,整理得Kθ=![]() SO2和O2起始物质的量之比为2:1,SO
SO2和O2起始物质的量之比为2:1,SO

则p(O2)=![]() ,
,
p(SO2)=![]() ,
,
p(SO3)=![]() ,
,
又因为p=pθ,则Kθ= ,故答案为:
,故答案为:![]() 。
。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】五氧化二钒(V2O5)在冶金、搪瓷、磁性材料等领域具有重要的应用。实验室以含钒废料(含有V2O3、CuO、MnO、SiO2、有机物)为原料制备V2O5的工艺流程如图所示。

已知:Ⅰ.含钒离子在溶液中的主要存在形式与溶液pH的关系如下表所示。
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要存在形式 | VO2+ | VO3- | V2O74- | VO43- |
Ⅱ.25℃时,部分难溶电解质的溶度积常数如下表所示。
难溶电解质 | Cu(OH)2 | Mn(OH)2 |
溶度积常数(Ksp) | 4.8×10-20 | 4×10-14 |
Ⅲ.25℃时,NH4VO3的溶解度为0.4gL-1;70℃时,NH4VO3的溶解度为63gL-1。
请回答下列问题:
(1)“焙烧”的目的是___。
(2)滤渣1的用途为___(任写一种)。
(3)“调pH”的目的除了使Cu2+沉淀完全外,还有___;调节pH为7时,Cu2+是否沉淀完全?___。(写出计算过程,当溶液中离子浓度小于10-5molL-1时,认为该离子沉淀完全)
(4)“沉锰”时,需将温度控制在70℃左右,温度不能过高或过低的原因为___。
(5)“浓缩结晶”后,需对所得NH4VO3进行洗涤、干燥。洗涤剂宜选用___;证明NH4VO3已洗涤干净的实验操作及现象为___。
(6)“煅烧”时,生成无污染性气体,该反应的化学方程式为___。
【题目】乙烯是重要的化工原料。用CO2催化加氢可制取乙烯:CO2(g)+3H2(g)![]()
![]() C2H4(g)+2H2O(g) ΔH<0
C2H4(g)+2H2O(g) ΔH<0
(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=__kJ/mol。(用含a、b的式子表示)
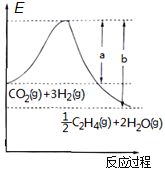
(2)几种化学键的键能如表所示,实验测得上述反应的△H=-76kJ/mol,则表中的x=__。
化学键 | C=O | H—H | C=C | C—H | H—O |
键能/kJ·mol-1 | x | 436 | 612 | 414 | 464 |
(3)向1L恒容密闭容器中通入1molCO2和nmolH2,在一定条件下发生上述反应,测得CO2的转化率α(CO2)与反应温度T、压强P的关系如图所示。
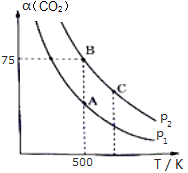
①P1___P2(填“>”、“<”或“=”,下同)。
②平衡常数KB__KC。
③若B点时投料比![]() =3,则平衡常数KB=__(代入数据列出算式即可,不用化简)。
=3,则平衡常数KB=__(代入数据列出算式即可,不用化简)。
④其他条件不变时,能同时满足增大反应速率和提高CO2转化率的措施是___。
A.将产物从体系不断分离出去 B.给体系升温
C.给体系加压 D.增大H2的浓度
(4)①以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则M极上的电极反应式为___。
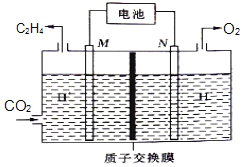
②已知乙烯也能做燃料电池,当消耗标况下2.24L乙烯时,导线中转移电子的数目为__。